
| A.AgCl>AgI>Ag2CrO4 | B.AgCl> Ag2CrO4>AgI |
| C.Ag2CrO4> AgCl> >AgI | D.Ag2CrO4> AgI> AgCl |
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①=②=③=④=⑤ | B.①>④>③>②>⑤ |
| C.⑤>④>①>③>② | D.④>③>⑤>①>② |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
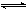 Ca2++2OH-
Ca2++2OH-| A.溶液中Ca2+数目增多 | B.溶液中Ca2+数目不变 |
| C.c(Ca2+)增大 | D.c(Ca2+)不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.白色沉淀为ZnS,黑色沉淀为CuS |
| B.上述现象说明ZnS的Ksp小于CuS的Ksp |
| C.利用该原理可实现一种沉淀转化为更难溶的沉淀 |
| D.该过程破坏了ZnS的溶解平衡 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶度积小的沉淀可以转化为溶度积更小的沉淀 |
| B.若先加入Na2S溶液,再加入KI溶液,则无黄色沉淀产生 |
| C.25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同 |
| D.25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解度不同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
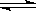 Ag+ + Cl-,现将足量的氯化银分别放入下列选项的溶液中,充分搅拌后,相同温度下,银离子浓度最小的是( )
Ag+ + Cl-,现将足量的氯化银分别放入下列选项的溶液中,充分搅拌后,相同温度下,银离子浓度最小的是( )| A.100mL蒸馏水中 | B.50mL0.1mol?L-1的氯化镁溶液 |
| C.150mL0.1mol?L-1的氯化钠溶液 | D.50mL0.1mol?L-1的氯化铝溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.9.0 | B.9.5 | C.8.5 | D.10.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com