
【题目】Y、Z、W、R、M五种元素,位于元素周期表的前四周期,它们的核电荷数依次增大,有如下信息:
元素 | 相关信息 |
Y | 原子核外有6个不同运动状态的电子 |
Z | 非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同 |
W | 主族元素,与Z原子的价电子数相同 |
R | 价层电子排布式为3d64s2 |
M | ⅠB族,其单质常用作导线 |
请回答下列问题(Y、Z、W、R、M用所对应的元素符号表示):
(1)Z、W元素相比,第一电离能较大的是_____________________,M2+的核外电子排布式为________________________。
(2)写出两个与YZ2互为等电子体的化学式_________________ 。
(3)WZ2分子中W原子价层电子对数是_____________对,WZ2的VSEPR 模型名称为_______________,WZ3气态为单分子,该分子中W原子的杂化轨道类型为__________________;WZ3的三聚体环状结构如图所示,该结构中W原子的杂化轨道类型为__________;该结构中W-Z键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为___________(填图中字母) ,该分子中含有______个σ键。
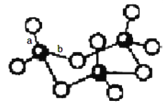
【答案】O 1s22s22p63s23p63d9或[Ar]3d9 CS2、SCN- 3 平面三角形 sp2 sp3 a 12
【解析】
Y、Z、W、R、M五种元素,位于元素周期表的前四周期,它们的核电荷数依次增大,Y原子核外有6个不同运动状态的电子,则Y为C元素;Z为非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同,则Z为O元素;W为主族元素,与Z原子的价电子数相同,为S元素;R价层电子排布式为3d64s2,R原子核外电子数=18+6+2=26,为Fe元素;M为ⅠB族,其单质常用作导线,为Cu元素,以此解答该题。
(1)Z为O元素,W为S元素,O、S元素位于同一主族,同一主族元素第一电离能随着原子序数增大而减小,所以第一电离能O>S;Cu为29号元素,失去2个电子生成Cu2+,该离子核外有27个电子,根据构造原理书写该离子核外电子排布式为1s22s22p63s23p63d9或[Ar]3d9;
(2)Y为C元素,Z为O元素,YZ2为CO2,由3个原子构成,价电子总数为16,等电子体的化学式CS2、SCN-;
(3)Z为O元素,W为S元素,WZ2为SO2,分子中S原子的成键电子对数为2,孤电子对数为![]() ×(6-2×2)=1,价层电子对数=成键电子对数+孤电子对数=2+1=3对,且含有一个孤电子对,根据价层电子对互斥理论判断SO2的VSEPR 模型名称为平面三角形,SO3气态为单分子,该分子中S原子的价层电子对数=3+
×(6-2×2)=1,价层电子对数=成键电子对数+孤电子对数=2+1=3对,且含有一个孤电子对,根据价层电子对互斥理论判断SO2的VSEPR 模型名称为平面三角形,SO3气态为单分子,该分子中S原子的价层电子对数=3+![]() =3,S原子采取sp2杂化;SO3的三聚体环状结构如图所示,该结构中S原子价层电子对个数是4,根据价层电子对互斥理论判断S原子的杂化轨道类型为sp3;SO3的三聚体中每个S形成S=O键和SO键,S=O键长较短,所以a较短;单键都为σ键,SO3的三聚体环状结构如图所示,该结构的分子中含有12个σ键。
=3,S原子采取sp2杂化;SO3的三聚体环状结构如图所示,该结构中S原子价层电子对个数是4,根据价层电子对互斥理论判断S原子的杂化轨道类型为sp3;SO3的三聚体中每个S形成S=O键和SO键,S=O键长较短,所以a较短;单键都为σ键,SO3的三聚体环状结构如图所示,该结构的分子中含有12个σ键。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是( )

A. 溶液中一定不含CO32﹣,可能含有SO42-和NO3-
B. 溶液中n(NH4+)="0.2" mol
C. 溶液中的阳离子只有H+、Mg2+、Al3+
D. n(H+)︰n(Al3+)︰n(Mg2+)=1︰1︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,体积为2L的两个恒容容器中发生:![]() 均为气态物质
均为气态物质![]() 有下表所示实验数据:
有下表所示实验数据:
容器编号 | 起始时各物质的物质的量 | 达到平衡时体系能量的变化 | ||
|
|
| ||
① | 1 | 3 | 0 |
|
② | 0 | 0 | 2 |
|
③ |
|
|
|
|
下列有关说法正确的是
A.![]()
B.②中![]() 的转化率大于③中
的转化率大于③中![]() 的转化率
的转化率
C.容器①与③分别达到平衡时,平衡常数相同,且![]()
D.将容器①的反应条件换为恒温恒压中进行![]() 投料量不变
投料量不变![]() ,达到平衡时,气体平均摩尔质量较恒温恒容时减小了
,达到平衡时,气体平均摩尔质量较恒温恒容时减小了
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为![]() 恒容密闭容器中发生反应:
恒容密闭容器中发生反应:
![]()
下列说法正确的是![]()
窗口编号 | 温度 | 起始物质的量 | 平衡物质的量 | |
|
|
| ||
1 | 380 |
|
|
|
2 | 380 |
| ||
3 | 230 |
|
|
|
A.该反应的正反应为放热反应
B.达到平衡时,容器1中的![]() 体积分数比容器2中的小
体积分数比容器2中的小
C.容器1中反应达到平衡所需的时间比容器3中的长
D.若起始时向容器Ⅲ中充入![]()
![]()
![]() 、
、![]()
![]()
![]() 和
和![]()
![]() ,则反应向逆反应方向进行
,则反应向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在密闭容器中进行下列反应:CO2(g)+C(s)![]() 2CO(g) ΔH>0,达到平衡后,若改变下列条件,则平衡如何移动?(填“向左移动”、“向右移动”或“不移动”)
2CO(g) ΔH>0,达到平衡后,若改变下列条件,则平衡如何移动?(填“向左移动”、“向右移动”或“不移动”)
(1)增加C(s),平衡___。
(2)减小密闭容器容积,保持温度不变,则平衡___。
(3)通入N2,保持密闭容器容积和温度不变,则平衡__。
(4)保持密闭容器容积不变,升高温度,则平衡__。
Ⅱ.在一密闭容器中发生下列反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,如图是某一时间段反应速率与反应进程的关系曲线图。
2NH3(g) ΔH<0,如图是某一时间段反应速率与反应进程的关系曲线图。
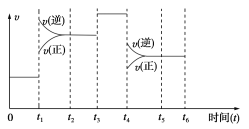
下列时间段中,氨的百分含量最高的是(_____)
A.0~t1 B.t2~t3
C.t3~t4 D.t4~t5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际计量大会第26次会议新修订了阿伏加德罗常数(Na = 6. 022214076×l023mol-1),并于2019年5月20日正式生效。下列说法不正确的是
A. 标准状况下11. 2 L的CH3Cl中含有氢原子的数目为1. 5NA
B. lmol Na2O2固体中含有阴、阳离子的总数目为3NA
C. l00mL lmolL-1 NH4Cl溶液中含有阳离子的数目大于0.1 NA
D. 18gD2O和H2O的混合物中含有的中子数为9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铜与一定量浓硝酸反应得到硝酸铜溶液和 NO2、N2O4、NO 的混合气体,这些气体与 4.48 L O2(标准状况)混合后通入水中,气体恰好完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入 400 mL NaOH溶液,此时 Cu2+恰好沉淀完全,所用 NaOH 溶液的浓度是( )
A.2 mol/LB.4 mol/LC.6 mol/LD.0.8 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,用
时,用![]() 二元弱酸
二元弱酸![]() 溶液滴定
溶液滴定![]() 溶液所得滴定曲线如图。下列说法不正确的是
溶液所得滴定曲线如图。下列说法不正确的是![]()
![]()

A.点![]() 所示溶液中:
所示溶液中:![]()
B.点![]() 所示溶液中:
所示溶液中:![]()
C.点![]() 所示溶液中:
所示溶液中:![]()
D.滴定过程中可能出现:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com