
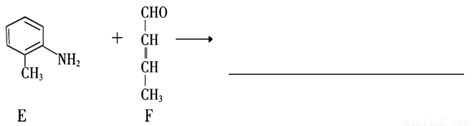
(16分)香兰素(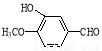 )是食品添加剂的增香原料,其合成路线如下:
)是食品添加剂的增香原料,其合成路线如下:
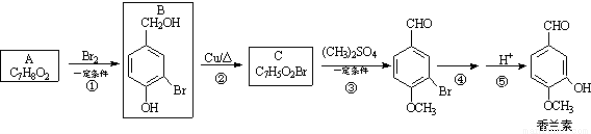
(1)写出A的结构简式 ,1 mol A完全反应消耗O2的物质的量为 mol。
(2)写出反应②的化学方程式_______________________________。
(3)反应③的反应类型是_____,1 mol香兰素在一定条件下与H2发生反应,最多消耗H2_________mol。
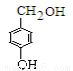
(4)D与香兰素互为同分异构体,能与NaHCO3溶液反应放出气体,遇FeCl3溶液显紫色,且苯环上的一氯取代物只有2种,请写出D的结构简式______。
(5)香兰素的另一种同分异构体结构简式为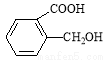 ,在一定条件下可以合成聚酯高分子,写出该聚酯高分子的结构简式_________。
,在一定条件下可以合成聚酯高分子,写出该聚酯高分子的结构简式_________。
(1) (2分) 8(2分) (2)
(2分) 8(2分) (2)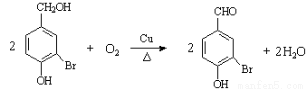 (3分)
(3分)
(3)取代反应(2分) 4 (2分) (4)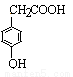 (2分)(5)
(2分)(5)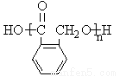 (3分)
(3分)
【解析】
试题分析:(1)根据B的结构简式可知,反应①是A分子酚羟基邻位的氢原子被溴原子取代,则A的结构简式为 。根据A的分子式C7H8O2可知,1 mol A完全反应消耗O2的物质的量为7mol+1mol=8mol。
。根据A的分子式C7H8O2可知,1 mol A完全反应消耗O2的物质的量为7mol+1mol=8mol。
(2)根据反应②的条件可知,该反应是醇羟基的催化氧化,方程式为
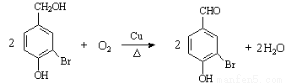 。
。
(3)根据C的结构简式可知反应③是酚羟基上的氢原子被甲基取代,所以取代反应;香兰素分子含有一个苯环和1个醛基,因此1 mol香兰素在一定条件下与H2发生反应,最多消耗H24mol;
(4)D与香兰素互为同分异构体,能与NaHCO3溶液反应放出气体,说明含有羧基;遇FeCl3溶液显紫色,说明含有酚羟基;且苯环上的一氯取代物只有2种,这说明苯环含有2个取代基,且是对位的,所以D的结构简式为 。
。
(5) 分子含有羧基和羟基,可以发生缩聚反应生成高分子化合物,其结构简式为
分子含有羧基和羟基,可以发生缩聚反应生成高分子化合物,其结构简式为
 。
。
考点:考查有机物推断、同分异构体、有机反应类型判断等


科目:高中化学 来源: 题型:
| A、拒绝脂肪 | B、对蛋白质要“亲疏有度” | C、科学饮食从“微量”元素做起 | D、饮食中不可缺“肠道的清道夫--纤维素” |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、非金属元素组成的化合物中可能含离子键 | B、ⅠA族金属元素是同周期中金属性最强的元素 | C、同种元素的原子均有相同的质子数 | D、ⅦA族元素的阴离子还原性越强,其氢化物越稳定 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省海珠等四区高三联考理综化学试卷(解析版) 题型:填空题
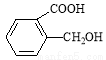
(16分)合成喹啉及其衍生物常用的方法是Skraup合成法,以下是用苯胺、甘油、浓硫酸和硝基苯共热制备喹啉的反应流程。
(1)上图中A的名称为 ,C的分子式为
(2)II的反应类型为
(3)下列关于化合物C的说法,正确的是
A.1mol化合物C最多能与3mol氢气反应
B.可发生银镜反应
C.能使酸性高锰酸钾溶液褪色
D.属于芳香烃
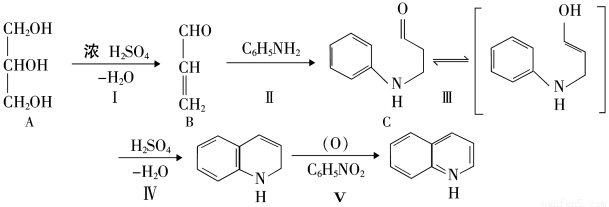
(4)①化合物E和F也能发生类似II的反应,请写出生成物的结构简式。
②化合物F有多种同分异构体,其中属于醛类的有(不包括该物质本身) (写结构简式)
查看答案和解析>>
科目:高中化学 来源:2015届广东省海珠等四区高三联考理综化学试卷(解析版) 题型:选择题
在水溶液中能大量共存的一组离子是
A.NH4+、Ag+、PO43-、Cl-
B.H+、I-、NO3-、Cl-
C.NH4+、OH-、Cl-、Ba2+
D.Mg2+、Na+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源:2015届广东省揭阳市高三上学期第一次阶段考试理综试卷(解析版) 题型:选择题
下列关于金属及其化合物的叙述正确的是
A.Fe与S混合加热生成FeS2
B.过量的Cu与浓硝酸会有NO生成
C.NaHCO3、Na2CO3、MgCO3受热均能分解生成气体
D.Na2O2与水反应、红热的Fe与水蒸气反应均能反应生成碱
查看答案和解析>>
科目:高中化学 来源:2015届广东省惠州市高三第二次调研考试化学试卷(解析版) 题型:填空题
(16分)脱水环化是合成生物碱类天然产物的重要步骤,某生物碱V合成路线如下:
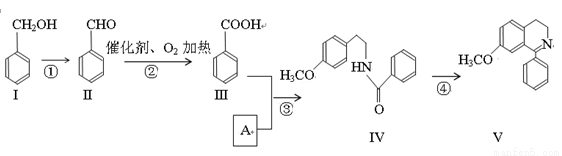
(1)Ⅱ中含氧官能团的名称 .
(2)反应②的化学方程式 。
(3)Ⅰ和Ⅲ在浓硫酸催化加热时反应的化学方程式 。
(4)下列说法正确的是 。
A. Ⅰ和Ⅴ均属于芳香烃 B. Ⅱ能发生银镜反应
C. Ⅱ能与4molH2发生加成反应 D. 反应③属于酯化反应
(5)A的结构简式 。
(6)Ⅵ与Ⅰ互为同分异构体,Ⅵ遇FeCl3发生显色反应,其苯环上的一氯代物只有2种。写出满足上述条件的Ⅵ的结构简式 。
(7) 一定条件下,化合物Ⅶ(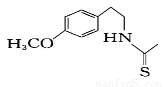 )也能发生类似反应④的环化反应,Ⅶ的环化产物的结构简式 。
)也能发生类似反应④的环化反应,Ⅶ的环化产物的结构简式 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三9月第二次月考化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值。下列说法正确的是
A.标况下,11.2L SO3所含的分子数目为0.5 NA
B.室温下,1L pH=1的稀硫酸溶液中,由水电离的H+离子数目为0.2NA
C.铅蓄电池放电时,正极消耗4mol H+,则电路中通过的电子数目为2NA
D.8 Al + 3NH4ClO4 =4 Al2O3 +3NH3 +3HCl 反应中,消耗27gAl粉时,转移的电子数目为2.75NA(Al原子量—27)
查看答案和解析>>
科目:高中化学 来源:2015届广东省佛山市高三9月考化学试卷(解析版) 题型:填空题
(10分)汽车尾气是城市空气的主要污染物,如何减少汽车尾气(CO、NOx等)的污染是重要的科学研究课题。
(1) 已知:N2(g) + O2(g) 2NO(g) ΔH1
2NO(g) ΔH1
N2(g) + 3H2(g) 2NH3(g) ΔH2
2NH3(g) ΔH2
2H2(g) + O2(g) 2H2O(g) ΔH3
2H2O(g) ΔH3
则4NO(g) + 4NH3(g) + O2(g) 4N2(g) + 6H2O(g) ΔH =____________(用ΔH1、ΔH2、ΔH3表达)
4N2(g) + 6H2O(g) ΔH =____________(用ΔH1、ΔH2、ΔH3表达)
(2) 在密闭容器中,一定条件下,进行如下反应:2NO(g)+2CO(g) N2(g)+2CO2(g),下列说法不能说明该反应达到平衡的是__________ (填字母)
N2(g)+2CO2(g),下列说法不能说明该反应达到平衡的是__________ (填字母)
A.NO的生成速率与NO的消耗速率相等
B.v(CO)=v(CO2)
C.体系的压强保持不变
D.各物质的浓度保持不变
(3) 可用活性炭还原法处理氮氧化物。有关反应的化学方程式为:
C(s) + 2NO(g) N2(g) + CO2(g) ΔH >0
N2(g) + CO2(g) ΔH >0
某研究小组向密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol·L-1
| NO | N2 | CO2 |
0
| 0.100
| 0
| 0
|
10
| 0.058
| 0.021
| 0.021
|
20
| 0.040
| 0.030
| 0.030
|
30
| 0.040
| 0.030
| 0.030
|
40
| 0.032
| 0.034
| 0.017
|
① 写出该反应的平衡常数表达式:K= 。
② 30 min后,改变某一条件,平衡发生了移动,则改变的条件是 ;若升高温度,NO浓度将 (填“增大”、“不变”或“减小”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com