
分析 (1)根据公式v=$\frac{△n}{V•△t}$计算v(NO),然后根据化学反应速率之比等于化学计量数之比计算v(H2O)、v(O2),△n(O2)=v(O2)×V×△t;
(2)A.反应物和产物都是气体;
B.达到化学平衡状态时,各组分的浓度保持恒定;
C.达到化学平衡状态时,正、逆反应速率相等且不为零;
D.该反应是体积缩小的反应,反应过程中气体的物质的量逐渐减小,压强逐渐减小;
(3)催化剂能够加快反应速率,降温反应速率减慢,容器体积不变时通入稀有气体反应速率不变;
(4)根据该反应为放热反应,反应过程中温度升高,此条件下比原平衡温度高进行分析反应速率变化;随后浓度变化成为影响反应速率的主要因素;
(5)根据三段法计算出各物质的平衡浓度,带入平衡常数表达式,
解答 解:(1)v(NO)=$\frac{1mol}{10L×5s}$=0.02mol/(L•s),则v(H2O)=$\frac{6}{4}$×0.02mol/(L•s)=0.03mol/(L•s),v(O2)=$\frac{5}{4}$×0.02mol/(L•s)=0.025mol/(L•s),
△n(O2)=v(O2)×V×△t=0.025mol/(L•s)×10L×5s=1.25mol,O2的转化率为$\frac{1.25mol}{5mol}$×100%=25%,
故答案为:0.03mol/(L•s);25%;
(2)A.反应物和产物都是气体,气体质量始终不变,故A错误;
B.c (O2)不变,说明正逆反应速率相等,达到了平衡状态,故B正确;
C.$\frac{v(NO)_{逆}}{v({O}_{2})_{逆}}$=$\frac{4}{5}$,所以4υ(O2)正=5υ(NO)逆=4υ(O2)逆,故C错误;
D.该反应是体积缩小的反应,反应过程中气体的物质的量逐渐减小,压强逐渐减小,若体系压强不变,说明正逆反应速率相等,达到了平衡状态,故D正确;
故答案为:BD;
(3)在容器中加入正催化剂,正反应速率和逆反应速率都增大,平衡不发生移动;降低温度,正逆反应速率同时减小,容器体积不变充入Ar,各组分浓度不变,反应速率不变,
故答案为:增大;减小;不变;,
(4)由于该反应为放热反应,若在容积固定的绝热密闭容器中发生上述反应,其余条件不变,反应过程中反应体系的温度高于原反应,所以正逆反应速率都增大,随后因浓度减小成为影响的主要因素,所以反应减慢,
故答案为:C;
(5)4NH3(g)+5O2(g)?4NO(g)+6H2O(g)
起始浓度(mol/L) 0.4 0.5 0 0
变化浓度(mol/L) 0.1 0.125 0.1 0.15
平衡浓度(mol/L) 0.3 0.375 0.1 0.15
K=$\frac{(0.{1}^{4}×0.1{5}^{6})}{(0.{3}^{4×}0.37{5}^{5})}$,
故答案为:$\frac{(0.{1}^{4}×0.1{5}^{6})}{(0.{3}^{4×}0.37{5}^{5})}$.
点评 本题考查了化学平衡状态的判断、化学平衡的影响因素、影响化学反应速率的因素,题目难度中等,注意掌握判断化学平衡状态的方法,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢氧燃料电池把氢气和氧气燃烧放出的热能转化为电能 | |
| B. | 电解水制取氢气是理想而经济的制氢方法 | |
| C. | 氢氧燃料电池汽车的使用可以有效减少城市空气污染 | |
| D. | 燃料电池的能量转化率可达100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的沸点:W<T<R | |
| B. | 离子半径:T->R2- | |
| C. | 最高价氧化物对应的水化物碱性:Y>X | |
| D. | XR2、WR2两化合物含有的化学键的类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HF>HCl>HBr | B. | 原子半径:Na>S>O | ||
| C. | 元素金属性:Na>Mg>Al | D. | 酸性:H3PO4>H2SO4>HClO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
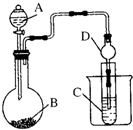
| A. | 仪器A的名称长颈漏斗,仪器 D的名称为球形干燥管 | |
| B. | 若利用上装置验证非金属性:Cl>S,装置A、B、C中所装药品应分别为稀盐酸、MnO2、Na2S溶液 | |
| C. | 若利用上装置证明非金属性:S>C>Si,装置A、B、C中所装药品应分别为稀硫酸、Na2CO3溶液、Na2SiO3溶液,观察到B中产生气泡,试管C中出现白色沉淀现象,则可以证明非金属性:S>C>Si | |
| D. | 装置A、B、C中所装药品应分别为稀盐酸、Na2CO3溶液、Na2SiO3溶液,观察到B中产生气泡,试管C中出现白色沉淀现象,则可以证明非金属性:Cl>C>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
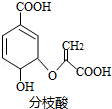
| A. | 可与乙醇、乙酸反应,且反应类型相同 | |
| B. | 分子中含有3种官能团 | |
| C. | 1mol分枝酸最多可与3molNaOH发生中和反应 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
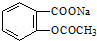 转变为
转变为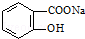 的方法为( )
的方法为( )| A. | 溶液加热,通入足量的HCl | |
| B. | 与足量的NaOH溶液共热后,再通入CO2 | |
| C. | 与稀H2SO4共热后,加入足量的Na2CO3 | |
| D. | 与稀H2SO4共热后,加入足量的NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C2H4Cl2的物质一定是纯净物 | |
| B. | 分子组成符合CnH2n+2的烃一定是烷烃 | |
| C. | 正戊烷分子中所有碳原子均在一条直线上 | |
| D. | 碳氢原子个数比为1:3的烃有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=10-6 mol•L-1的溶液一定呈酸性 | |
| B. | PH=7的溶液一定呈中性 | |
| C. | c(OH-)=c(H+)的溶液一定呈中性 | |
| D. | 不能使酚酞试液变红的溶液一定呈酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com