


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、22.4LH2的质量为2g |
| B、CO2的摩尔质量为44g |
| C、1molMg的最外层由1.204×1024个电子 |
| D、2mol/LNa2SO4的溶液中SO42-为1.204×1024个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在硫化氢水溶液中加入碱有利于S2-的生成 |
| B、加入催化剂有利于氨的氧化反应 |
| C、高压有利于合成氨反应 |
| D、向新制氯水中加入碳酸钙有利于次氯酸浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、少量的二氧化硫气体通入冷氨水中:SO2+NH3?H2O═HSO3-+NH4+ |
| B、H218O 中投入Na2O2固体:2H218O+2Na2O2═4Na++4OH-+18O2↑ |
| C、碳酸氢钙溶液中加过量澄清石灰水:Ca2++OH-+HCO3-═CaCO3↓+H2O |
| D、碳酸钠的水解反应:CO32-+H3O+?HCO3-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Na+ Al3+ Mg2+ Ba2+ Fe3+ |
| 阴离子 | Cl- OH- NO3- CO32- X |
查看答案和解析>>
科目:高中化学 来源: 题型:
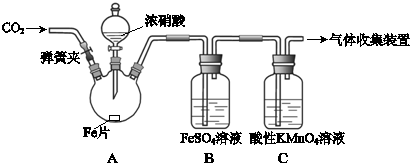
| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹. | |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. | 无明显现象. |
| 加热烧瓶,反应开始后停止加热. | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅; B中溶液变棕色; C中溶液紫色变浅.②反应停止后,A中无固体剩余. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com