
关于金属元素在自然界存在的情况的叙述中,正确的是( )
A.金属元素仅存在于矿物中
B.金属元素存在于矿物和动物体内,植物体内不含
C.少数金属元素以游离态存在,大多数金属元素以化合态存在
D.金属元素在自然界中都以化合态形式存在
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:
科学家预测,氨有望取代氢能,成为重要的新一代绿色能源。下列有关说法不正确的是
A.液氨作为清洁能源的反应原理是4NH3+5O2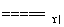 4NO+6H2O
4NO+6H2O
B.液氨具有腐蚀性和毒性,在使用过程中要防止液氨泄漏
C.氨气比空气轻,标准状况下密度约为0.76 g·L-1
D.氨气与氢气相比,优点在于氨气不容易发生爆炸,使用时更安全
查看答案和解析>>
科目:高中化学 来源: 题型:
氨和联氨(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
根据题意完成下列计算:
(1)联氨用亚硝酸氧化生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,计算确定该氢化物的分子式。
该氢化物受撞击则完全分解为氮气和氢气。4.30 g该氢化物受撞击后产生的气体在标准状况下的体积为________L。
(2)联氨和四氧化二氮可用作火箭推进剂,联氨是燃料,四氧化二氮作氧化剂,反应产物是氮气和水。
由联氨和四氧化二氮组成的火箭推进剂完全反应生成72.0 kg水,计算推进剂中联氨的质量。
(3)氨的水溶液可用于吸收NO与NO2混合气体,反应方程式为:
6NO+4NH3—→5N2+6H2O
6NO2+8NH3—→7N2+12H2O
NO与NO2混合气体180 mol被8.90×103g氨水(质量分数0.300)完全吸收,产生156 mol氮气。吸收后氨水密度为0.980 g·cm-3。
计算:①该混合气体中NO与NO2的体积比。
②吸收后氨水的物质的量浓度(答案保留1位小数)。
(4)氨和二氧化碳反应可生成尿素CO(NH2)2。尿素在一定条件下会失去氨而缩合,如两分子尿素失去一分子氨形成二聚物:
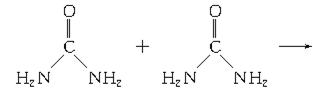
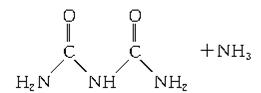
已知常压下120 mol CO(NH2)2在熔融状态发生缩合反应,失去80 mol NH3生成二聚物(C2H5N3O2)和三聚物。测得缩合产物中二聚物的物质的量分数为0.60,推算缩合产物中各缩合物的物质的量之比。
查看答案和解析>>
科目:高中化学 来源: 题型:
目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:
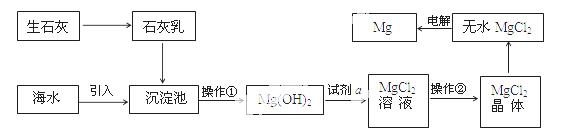
提示:  ①MgCl2晶体的化学式为MgCl2•6H2O;
①MgCl2晶体的化学式为MgCl2•6H2O;
②MgO的熔点为2852℃,无水MgCl2的熔点为714℃。
(1)操作①的名称是 , 操作②的名称 、 、过滤。
(2)试剂a的名称是 。
(3)用氯化镁电解生产金属镁的化学方程式为: 。
(4)工业上是将氢氧化镁转变为氯化镁,再电解氯化镁来制取镁单质;而不采用:加热Mg(OH)2得到MgO,再电解熔融MgO的 方法制金属镁,其原因是 。
方法制金属镁,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工业上冶炼钼的化学原理为
①2MoS2+7O2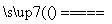 2MoO3+4SO2;
2MoO3+4SO2;
②MoO3+2NH3·H2O===(NH4)2MoO4+H2O;
③(NH4)2MoO4+2HCl===H2MoO4↓+2NH4Cl;
④H2MoO4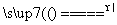 MoO3+H2O;
MoO3+H2O;
⑤用还原剂将MoO3还原成金属钼。
则下列说法正确的是 ( )
A.MoS2煅烧产生的尾气可直接排入空气中
B.MoO3是金属氧化物,也是碱性氧化物
C.H2MoO4是一种强酸
D.利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为3∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于海水的知识不正确的是( )
A.海水资源的利用包括海水水资源利用和化学资源利用
B.海水既苦又涩,不能直接利用
C.海水中某些金属元素总储量很大,但富集程度却很低
D.海水淡化应同化工生产结合,同能源技术结合
查看答案和解析>>
科目:高中化学 来源: 题型:
对三种金属元素R、U、T进行了如下的实验:
| R | U | T | |
| 和稀硫酸反应 | 溶解并放出气体 | 无反应 | 未实验 |
| 和T的硝酸盐反应 | 表面上析出T | 表面上析出T | 未实验 |
据此可知这三种金属活动性由弱到强的顺序是( )
A.T、R、U B.T、U、R
C.U、R、T D.U、T、R
查看答案和解析>>
科目:高中化学 来源: 题型:
用铝箔包裹0.1 mol金属钠,用针扎出一些小孔,放入水中,完全反应后用排水集气法收集产生的气体,则收集到的气体为(标准状况)( )
A.O2和H2的混合气体 B.1.12  L H2
L H2
C.大于1.12 L H2 D.小于1.12 L H2
查看答案和解析>>
科目:高中化学 来源: 题型:
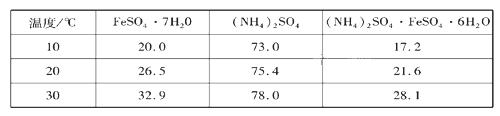
硫酸亚铁可与等物质的量的硫酸铵生成硫酸亚铁铵:(NH4)2SO4·FeSO4·6H2O,商品名称为莫尔盐,是一种复盐。一般亚铁盐在空气中易被氧气氧化,形成复盐后就比较稳定。与其他复盐一样,硫酸亚铁铵在水中的溶解度比组成它的每一种盐的溶解度都小,且几乎不溶于乙醇,利用这一性质可以制取硫酸亚铁铵晶体。三种盐的溶解度(单位为g/l00gH2O)见下表:
实验用品: Fe屑(含少量碳)、3mol/LH2SO4、( NH4)2SO4、蒸馏水、无水乙醇。
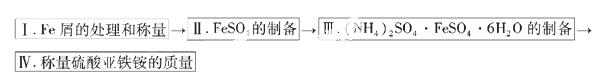
实验步骤流程图:
请完成以下实验记录:
(1)步骤I中用10% Na2CO3的热溶液处理铁屑的目的是 ,经处理后的干燥铁屑质量记为m1;
(2)将称量好的Fe屑放入锥形瓶中, 加入适量3mol/LH2SO4溶液,放在水浴中加热至气泡量产生较少时为止(有氢气生成,用明火加热注意安全)。趁热过滤,并用少量热水洗涤锥形瓶及滤纸,将滤液和洗涤液一起转移至蒸发皿中。将滤纸上的固体常温干燥后称重,记为m2;
加入适量3mol/LH2SO4溶液,放在水浴中加热至气泡量产生较少时为止(有氢气生成,用明火加热注意安全)。趁热过滤,并用少量热水洗涤锥形瓶及滤纸,将滤液和洗涤液一起转移至蒸发皿中。将滤纸上的固体常温干燥后称重,记为m2;
(3)称取一定质量的(NH4)2SO4,加入______ g(用含m1和m2的代数式表示,要求化简,下同。)水配制成室温下(20℃)的饱和溶液,并将其加入到上面实验的蒸发皿中,缓缓加热,浓缩至表面出现结晶薄膜为止。放置冷却,得到硫酸亚铁铵的晶体,过滤后用____________洗涤晶体。
(4)产品纯度的测定
先称取产品1.600g,加水溶解,配成100ml溶液,移取25.00mL待测溶液与锥形瓶中,再用硫酸酸化的0.0100mol/LKMnO4标准溶液进行滴定其中的Fe2+,达到滴定终点时消耗标准液的平均值为20.00mL,则样品中的(NH4)2SO4·FeSO4·6H2O的质量分数?(列式计算)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com