
 应速率增大,根据你学到的知识分析,反应速率增大的原因是________________ __________________。当进行一段时间后,反应速率又减慢,这次速率减慢的原因是_______________________________。
应速率增大,根据你学到的知识分析,反应速率增大的原因是________________ __________________。当进行一段时间后,反应速率又减慢,这次速率减慢的原因是_______________________________。 CH3COCH2I+H++I-。25℃时,该反应的速率由下列经验公式决定:
CH3COCH2I+H++I-。25℃时,该反应的速率由下列经验公式决定:科目:高中化学 来源:不详 题型:实验题
 B(g) + D(g) 在4种不同条件下进行,B和D的起始浓度为0 ,反应物A 的浓度(mol?L-1) 随反应时间 (min) 的变化情况如下表:
B(g) + D(g) 在4种不同条件下进行,B和D的起始浓度为0 ,反应物A 的浓度(mol?L-1) 随反应时间 (min) 的变化情况如下表: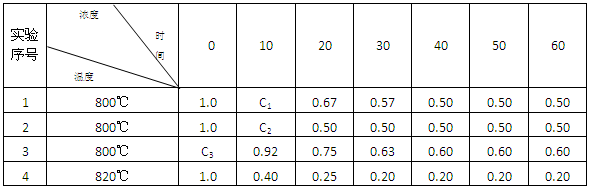
 B(g) + D(g) 是一个放热反应,那么实验4与实验1相比, 放出的热量多,理由是 。
B(g) + D(g) 是一个放热反应,那么实验4与实验1相比, 放出的热量多,理由是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3,反应开始时,反应速率由大到小排列顺序正确的是( )
2SO3,反应开始时,反应速率由大到小排列顺序正确的是( )| 容器 | 温度 | SO2(mol) | O2(mol) | 催化剂 |
| 甲 | 5000C | 10 | 5 | - |
| 乙 | 5000C | 8 | 5 | V2O5 |
| 丙 | 4500C | 8 | 5 | - |
| 丁 | 5000C | 8 | 5 | - |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3(g) (正反应放热),工业合成氨采用在500℃的条件下进行的原因是
2NH3(g) (正反应放热),工业合成氨采用在500℃的条件下进行的原因是| A.③④ | B.①② | C.①③ | D.②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H=b的NaOH溶液10V mL时,溶液中的Cl-和Na+的物质的量相等,则a+b的值是
H=b的NaOH溶液10V mL时,溶液中的Cl-和Na+的物质的量相等,则a+b的值是 | A.13 | B.14 | C.15 | D.不能确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 ,某化学研究小组的同学分别设计了如图甲、乙、丙所示的实验。请回答相关问题:
,某化学研究小组的同学分别设计了如图甲、乙、丙所示的实验。请回答相关问题:
 ____。
____。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 最快的是:
最快的是:| | 金属(粉末状)/mol | 酸的浓度和体积(mL) | 反应温度 | ||
| A | Mg | 0.1 | 3mol/LH2SO4 | 10 | 20℃ |
| B | Al | 0.1 | 3mol/LHCl | 10 | 20℃ |
| C | Zn | 0.1 | 3mol/LCH3COOH | 10 | 20℃ |
| D | Fe | 0.1 | 6mol/LHNO3 | 10 | 20℃ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com