
【题目】如图是N2与H2反应的能量变化曲线图。下列叙述正确的是
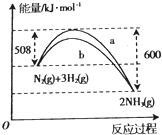
A. 该反应的热化学方程式为:N2(g) + 3H2(g) ![]() 2NH3(g),△H = +92 kJ/mol
2NH3(g),△H = +92 kJ/mol
B. b曲线是加入催化剂时的能量变化曲线
C. 加入催化剂,该化学反应的反应热减小
D. 加入催化剂可增大正反应速率,降低逆反应速率
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】在100 mL FeBr2溶液中通入标准状况下2.24 L Cl2,溶液中有![]() 的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为( )
的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为( )
A.4 mol L-1B.![]() mol L-1C.
mol L-1C.![]() mol L-1D.
mol L-1D.![]() mol L-1
mol L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质结构揭示物质构成的奥秘,请回答以下问题:
(1)元素A含有8个质子,10个中子的核素,用核素符号表示为______。元素B被科学家称“防癌之王”,与元素A同主族位于第四周期,元素B的名称为______,A和B的氢化物,沸点较高的是_____(填化学式)。
(2)CH4中共用电子对偏向C,SiH4中硅元素为+4价,则C、Si、H的电负性由大到小的顺序为______。
(3)如图是前四周期主族元素第一电离能梯度图,图中a点对应的元素为氢,则b点对应元素的未成对电子数为______,c点对应元素基态原子价电子排布式为_______。
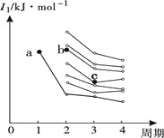
(4)FeC13晶体易溶于水、乙醇,用酒精灯加热即可气化,而FeF3晶体熔点高于1000℃,试解释两种化合物熔点差异较大的原因是____。
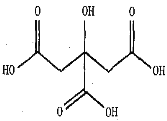
(5)水果中含有不同的果酸,其中柠檬、柑橘等水果中含有柠檬酸,柠檬酸的结构如下图。柠檬酸的晶体类型为_____,碳原子的杂化轨道类型为_____;柠檬酸晶体中含有的作用力有___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是2:1
B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
D.NO2和N2O4的混合气体中,NO2的体积分数是80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验。
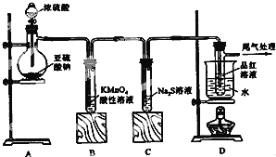
下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是___ ,发生反应的化学方程式为___;
(2)实验过程中,装置B、C中发生的现象分别是___、___,这些现象分别说明SO2具有的性质是___和___;装置C中发生反应的离子方程式为___;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象___;
(4)尾气可采用___溶液吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用混有硫酸亚铁和硫酸镁等杂质的锰矿(含MnO2、MnCO3)生产硫酸锰,实验室模拟生产过程如下:
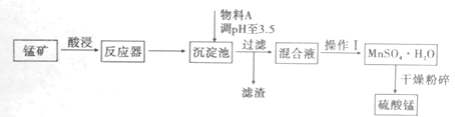
已知金属离子完全沉淀时的pH值如下:Fe3+:3.5;Fe2+:9.5;Mn2+:10.8;Mg2+:11.6。
(1)反应器中发生氧化还原反应的离子方程式是________。
(2)从经济效益考虑,物料A可以是________。
(3)硫酸锰和硫酸镁的溶解度曲线如右图所示:
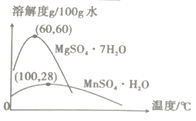
则操作Ⅰ包含的主要操作为________。
(4)MnSO4·H2O在1150℃条件下分解,产物是Mn2O4、含硫化合物、水,在该条件下硫酸锰晶体分解反应的化学方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某容器中加入足量的碳酸钙,发生反应CaCO3(s)![]() CaO(s)+CO2(g),达到平衡,下列说法正确的是
CaO(s)+CO2(g),达到平衡,下列说法正确的是
A. 将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度不变
B. 将体积增大为原来的2倍,再次达到平衡时,气体的密度变大
C. 因CaCO3(s)需加热条件才分解生成CaO(s)和CO2(g),所以是△H<0
D. 保持容器压强不变,充入He,平衡向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:D为烃;E分子中碳元素与氢元素的质量之比6∶1,相对分子质量为44,其燃烧产物只有CO2和H2O。A的最简式与F相同,且能发生银镜反应,可由淀粉水解得到。
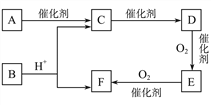
(1)A的结构简式为__________________。
(2)写出D→E的化学方程式:_______________________。
(3)下列说法正确的是____。
A.有机物F能使石蕊溶液变红
B.用新制的氢氧化铜无法区分有机物C、E、F的水溶液
C.等物质的量的C和D分别完全燃烧消耗氧气的量相等
D.可用饱和碳酸钠溶液除去有机物B中混有的少量C、F
E. B的同分异构体中能发生银镜反应的酯类共有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2SO2+O2![]() 2SO3在密闭容器中进行。下列说法正确的是( )
2SO3在密闭容器中进行。下列说法正确的是( )
A.使用催化剂不能改变反应速率
B.达平衡时SO2与SO3的浓度相等
C.增大压强能加快反应速率
D.SO2与O2反应能完全转化为SO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com