
【题目】碳酸亚铁(白色固体,难溶于水)是一种重要的工业原料,可用于制备补血剂乳酸亚铁,也可用作可充电电池的电极。某研究小组通过下列实验,寻找利用复分解反应制备 FeCO3 沉淀的最佳方案:
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
| 0.8 mol/L FeSO4 溶液(pH=4.5) | 1 mol/L Na2CO3 溶液(pH=11.9) | 实验Ⅰ:立即产生灰绿色沉淀,5min 后出现明显的红褐色 |
0.8 mol/L FeSO4 溶液(pH=4.5) | 1 mol/L NaHCO3 溶液 (pH=8.6) | 实验Ⅱ:产生白色沉淀及少量无色气泡,2min 后出现明显的灰绿色 | |
0.8 mol/L (NH4)2Fe(SO4)2 溶液(pH=4.0) | 1 mol/L NaHCO3 溶液 (pH=8.6) | 实验Ⅲ:产生白色沉淀及无色气泡,较长时间保持白色 | |
(1)实验 I 中红褐色沉淀产生的原因可用如下反应表示,请补全反应:
____Fe2+ +_______ ______+____ _______ +____H2O=____Fe(OH)3 ↓+____HCO3
(2)实验 II 中产生 FeCO3 的离子方程式为_____________________________。
(3)为了探究实验 III 中 NH4+所起的作用,甲同学设计了实验 IV 进行探究:
操作 | 现象 | |
实验IV | 向 0.8 mol/L FeSO4 溶液中加入①__________,再加入 Na2SO4 固体配制成混合溶液(已知 Na+对实验无影响,忽略混合后溶液体积变化)。再取该溶液一滴管,与 2mL 1 mol/L NaHCO3 溶液混合 | 与实验 III 现象相同 |
实验 IV 中加入 Na2SO4 固体的目的是②_______________________。
对比实验 II、III、IV,甲同学得出结论:NH4+水解产生 H+,降低溶液 pH,减少了副物 Fe(OH)2 的产生。
乙同学认为该实验方案不够严谨,应补充的对比实验操作是:③_____________,再取该溶液一滴管,与2mL 1 mol/L NaHCO3 溶液混合。
(4)小组同学进一步讨论认为,定性实验现象并不能直接证明实验 III 中 FeCO3 的纯度最高,需要利用如图所示的装置进行定量测定。分别将实验 I、II、III 中的沉淀进行过滤、洗涤、干燥后称量,然后转移至 A 处的广口瓶中。
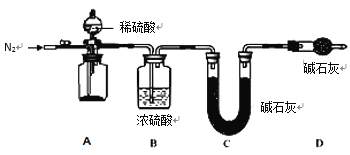
为测定 FeCO3 的纯度,除样品总质量外,还需测定的物理量是______________________。
(5)实验反思:经测定,实验 III 中的 FeCO3 纯度高于方案 I 和方案 II。通过以上实验分析,制备 FeCO3 实验成功的关键因素是__________________________________。
【答案】4 8 CO32 1 O2 10 4 8 Fe2+ + 2HCO3 =FeCO3↓+ CO2↑+ H2O 酸至 pH=4.0 控制 SO42- 浓度一致 0.8mol/L FeSO4溶液中加入 Na2SO4 固体至 c(SO42-)=1.6 mol/L C中 U 形管的增重 调节溶液 pH
【解析】
(1) Fe2+被氧气氧化为铁离子,铁离子与碳酸根离子发生水解生成Fe(OH)3;根据电子得失守恒:Fe2+→Fe(OH)3,铁元素化合价升高了1,O2→2O-2,化合价降低了4,因此,Fe2+、Fe(OH)3前面系数为4,氧气前面系数为1,再根据电荷守恒,CO32、和HCO3前面系数为8,最后再根据原子守恒,水前面系数为10,具体系数如下:4Fe 2+ + 8CO32 +1 O2 + 10H2O= 4Fe(OH) 3 + 8HCO3 ;
(2)根据实验现象可知,亚铁离子与碳酸氢根离子反应,生成FeCO3和 CO2,离子方程式为:Fe2+ + 2HCO3 =FeCO3↓+CO2↑+H2O;
(3)①探究同一酸性环境下的铵根离子的作用,因此要用硫酸调控溶液的pH=4.0;
②为了保证溶液中的硫酸根离子浓度的不变,向溶液中加入硫酸钠来控制SO42- 浓度;
③为了增强实验的严谨性,还应向0.8mol/L FeSO4溶液中加入 Na2SO4 固体至 c(SO42-)=1.6 mol/L,同一条件下做对比试验,这样结论更准确;
(4)碳酸铁和稀硫酸反应生成二氧化碳气体,水蒸气被浓硫酸吸收后,碱石灰(C)吸收二氧化碳气体,通过测定C中U 形管的增重,测出反应产生二氧化碳气体的量,最后根据反应关系来测定FeCO3 的纯度;
(5)通过三组实验分析可知,溶液的pH不同,生成FeCO3 的量不同,因此制备 FeCO3 实验成功的关键因素是调节溶液 pH。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】下列各项叙述中正确的是( )
A.同一原子的能层越高,s电子云半径越大
B.在同一个电子层上运动的电子,其自旋方向肯定不同
C.杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对
D.镁原子的核外电子排布由1s22s22p63s2变为1s22s22p63p2时,释放能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知K2Cr2O7溶液中存在如下平衡:Cr2O72-(橙色)+H2O![]() 2H++2CrO42-(黄色)。
2H++2CrO42-(黄色)。
①向2mL0.1mol·L-1K2Cr2O7溶液中滴入3滴6mol·L-1NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色;
②向酸化K2Cr2O7溶液中滴入适量Na2SO3溶液,溶液由橙色变为绿色:Cr2O72-+8H++3SO32-=2Cr3+(绿色)+3SO42-+4H2O。下列分析正确的是()
A.CrO42-和S2-在酸性溶液中可大量共存
B.实验②说明氧化性:Cr2O72->SO42-
C.稀释K2Cr2O7溶液时,溶液中各离子浓度均减小
D.实验①和②均能证明K2Cr2O7溶液中存在上述平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室探究SO2与Fe(NO3)3溶液反应的原理,装置如下图,实验中Y装置产生白色沉淀。下列说法不正确的是
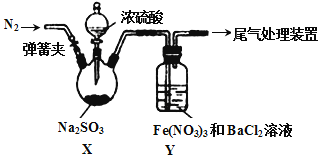
A. 滴加浓硫酸之前应进行的操作是打开弹簧夹,通入一段时间N2
B. Y中产生的白色沉淀是BaSO4或BaSO3
C. 产生白色沉淀的原因可能是在酸性条件下SO2与NO3- 反应生成了SO42-
D. 若将Fe(NO3)3换成FeCl3,Y中也能产生白色沉淀,说明Fe3+也能将SO2氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是( )

A.图1中正极电极反应式为:![]()
B.图2表示室温下![]() 的HCl溶液加水稀释倍数与pH的变化关系
的HCl溶液加水稀释倍数与pH的变化关系
C.图3表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
D.图4表示向![]()
![]() 溶液中逐滴滴入
溶液中逐滴滴入![]() 溶液,生成沉淀总物质的量
溶液,生成沉淀总物质的量![]() 随着
随着![]() 溶液体积
溶液体积![]() 的变化
的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.32 g S8(分子结构:![]() )中的共价键数目为NA
)中的共价键数目为NA
B.2 g由H218O和2H2O组成的物质中含有的质子数为NA
C.8 g CuO与足量H2充分反应生成Cu,该反应转移的电子数为0.2NA
D.标准状况下,22.4 L 辛烷在O2中完全燃烧产生的CO2的分子数为8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述不正确的是( )

A.WZ的水溶液呈中性
B.Y的最高价氧化物的水化物是强酸
C.元素非金属性的顺序为Z>Y>X
D.该新化合物中Y满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌锰干电池是最早使用的化学电池,其基本构造如图1所示:

![]()

(1)锌锰干电池的电路中每通过![]() ,理论上负极质量减少 ______ g;工作时
,理论上负极质量减少 ______ g;工作时![]() 离子在正极放电产生两种气体,其中一种气体分子是含
离子在正极放电产生两种气体,其中一种气体分子是含![]() 的微粒,正极的电极反应式是 ______
的微粒,正极的电极反应式是 ______
(2)某研究小组对电池内黑色糊状物进行了下列实验:
已知:![]() 是两性氢氧化物,完成下列实验报告:
是两性氢氧化物,完成下列实验报告:
实验步骤 | 实验现象 | 实验结论和解释 |
取少量上述无色溶液于试管中,逐滴加入NaOH溶液,直至过量,再加热 | 生成白色沉淀, ______ | 无色溶液中存在 检验 |
(3)利用残渣中分离出的![]() ,研究其在
,研究其在![]() 制
制![]() 过程中的作用.实验装置如图2所示。将等物质的量浓度、等体积
过程中的作用.实验装置如图2所示。将等物质的量浓度、等体积![]() 溶液加入烧瓶中,分别进行2个实验
溶液加入烧瓶中,分别进行2个实验![]() 气体的体积在相同条件下测定
气体的体积在相同条件下测定![]() 。
。
序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释 |
实验一 | 足量 | 收集到56mL气体 |
|
实验二 | 足量 | 黑色粉末部分溶解,收集到112mL气体 |
|
实验1、2中参加反应的![]() 的物质的量之比为 ______ ,实验二中反应的离子方程式为 ______。
的物质的量之比为 ______ ,实验二中反应的离子方程式为 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在三个体积均为2L的恒容密闭容器中发生如下反应:PCl5(g)![]() PCl3(g)+Cl2(g),测得实验数据如表:下列说法正确的是
PCl3(g)+Cl2(g),测得实验数据如表:下列说法正确的是
编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | 达到平衡所需时(s) | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
Ⅱ | 320 | 0.80 | a | a | t1 |
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t1 |
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅰ>容器Ⅲ
C.反应到达平衡时,a>0.2 mol
D.起始时向容器Ⅲ中充入0.30 mol PCl5(g)、0.45 molPCl3(g)和0.10 mol Cl2(g),则反应朝逆向进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com