
��11�֣���1.92 gͭ����һ������Ũ�����У����ȣ�����ͭ�IJ��ϼ��٣���Ӧ���ɵ�������ɫ��dz����ͭ��Ӧ���ʱ��ͭƬ��ȫ��ʧ�������ռ������������1.12 L���費��N2O4������
��1���ռ�������������Ҫ�к��� ��
��2�����������У��йط�Ӧ�Ļ�ѧ����ʽΪ �� ��
��3����Ӧ�б���ԭ��HNO3�����ʵ����� ��
��4�����ռ��������������������ʢ��ˮ��ˮ���У��������л���ͨ��O2��ʹ���ַ�Ӧ����Ҫʹˮǡ�ó�����������������Ҫ�μӷ�Ӧ��O2�����ʵ����Ƕ���Ħ������������̣�
��1��NO2 NO��2�֣� ��2��Cu + 4HNO3(Ũ) = Cu(NO3)2+2NO2��+2H2O ��2�֣�
3Cu+8HNO3(ϡ)=3Cu��NO3��2+2NO��+4H2O��2�֣���3��0.05 mol��2�֣���4��0.015 mol��3�֣���ֻ�н��û�й��̣������֡���
��������
������������ݷ�Ӧ����Ӧ�����������ɫ��dz����˵����NO���ɣ��跴Ӧ���ɵ�NO2��NO�����ʵ����ֱ�Ϊxmol��ymol��1.92g Cu�����ʵ���Ϊ0.03mol��1.12L��������ʵ���Ϊ0.05mol�����ݣ�
Cu + 4HNO3(Ũ) ��Cu( NO3)2 +2NO2��+ 2H2O
1 4 2
0.5x 2x x
3Cu +8HNO3(ϡ) ��3Cu( NO3)2 +2NO��+ 4H2O
8 2
1.5y 4y y ���У�0.5x+1.5y=0.03 x+y=0.05 ��:x=0.045mol y=0.005mol��1�����ݷ����ռ�������������Ҫ�к���NO2 �� NO����2�������ķ�Ӧ��Cu + 4HNO3(Ũ) ��Cu( NO3)2 +2NO2��+ 2H2O ��3Cu +8HNO3(ϡ) ��3Cu( NO3)2 +2NO��+ 4H2O����3������Ԫ���غ㣬����ԭ����������ʵ�����������NO2 �� NO֮�ͣ�Ϊ0.05mol����4������������ԭ��Ӧ�е�ʧ������ȣ�NO2 �� NO��������ȫ��Ӧת�Ƶĵ��ӵ���ͭ�����ᷴӦת�Ƶĵ���������ת�Ƶĵ���Ϊ��0.03mol��2=0.06mol,ת��0.06mol�ĵ�����Ҫ���������ʵ���Ϊ��0.06mol/4=0.015mol.
���㣺���ʵ����ļ��㣬������ԭ��Ӧ�ĵ���ת�Ƽ��㣬��ʧ�����غ���ɵ�Ӧ�á�


 ��ѧ��������������Ͼ���ѧ������ϵ�д�
��ѧ��������������Ͼ���ѧ������ϵ�д� �ϴ�̸�������������νӽ̳��Ͼ���ѧ������ϵ�д�
�ϴ�̸�������������νӽ̳��Ͼ���ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ�����и�һ��ѧ�����п��Ի�ѧ���������棩 ���ͣ������
��6*1�֣�ij��Һ�к���SO42-��CO32-��Cl-���������ӡ����ÿ��ֻ����һ�����ӣ�Ҫ��
��1���ȼ���CO32-������ �Լ�������Һ������Ӧ�����ӷ���ʽΪ ��
��2��Ȼ�����SO42������ �Լ�������Һ������Ӧ�����ӷ���ʽΪ ��
��3��������Cl-������ �Լ�������Һ������Ӧ�����ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ�����и����������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����
A��7.1g����������������������Һ��Ӧת�Ƶĵ�����Ϊ0.2��6.02��1023
B����״���£�22.4LNO��11.2L O2��Ϻ�����ķ�������Ϊ1.0��6.02��1023
C����ҵ�õ�ⷨ���д�ͭ����ʱ��ÿת��1mol���ӣ��������ܽ��ͭԭ����Ϊ0.5��6.02��1023
D��V L a mol��L��1���Ȼ�����Һ�У���Fe3+����ĿΪ6.02��1023����Cl����Ŀ����3��6.02��1023
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�л���A��B��C��D��E���dz������л���ܷ�����ͼ��ʾ��ת������֪A�ķ���ʽΪC10H20O2 ��
����ϴ�ת����ϵ��A�Ŀ��ܽṹ��
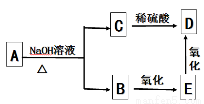
A��2�� B��3�� C��4�� D��5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���з�Ӧ���ͣ�����������ȡ��������ȥ���ܼӳɡ���ˮ�⡢��ԭ���������л�������������ǻ�����
A���٢ڢۢ� B���ڢܢ� C���ڢܢݢ� D���ڢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ������һ�����У��һ��ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
��̼���ƺ�̼�����ƵĹ�������Wg����ˮ�Ƴ�500mL��Һ�������ӵ����ʵ���Ũ��Ϊ0.4mol��L-1������Wg�û�����þƾ��Ƽ������������ٸı�ʱ���õ��Ĺ������ʵ�����������
A��5.3g B��3.1g C��4.2g D��10.6g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ������һ�����У��һ��ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
���и������ӣ���ǿ������Һ�п��Դ����������
A��Mg2+��Fe3+��SCN-��Cl- B��Na+��K+��NO3- Ba2+
C��Na+��K+��HCO3-��Cl- D��Fe2+��I-��NO3-��Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ������һ�����У�߶���ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£�����CH3COONa��˵�������ж���ȷ����
A��c(CH3COO��)��c(Na��)��c(OH��)��c(H��)
B�������¶ȣ�c(OH��)��c(CH3COO��)�ı�ֵ����С
C��CH3COONaϡ��Һ��ˮϡ��ʱ����Һ�и�����Ũ�Ⱦ���С
D��c(CH3COO��)+ c(CH3COOH)=c(Na��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�Ϫ�ظ߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����о������������к��еĿ�������ij�ֿ��������ijɷ�֮һ���������е������ɻ���������ã�ʹ�˵�����Ѫ�ܸ����ᡣ����������ģ����ͼ��ʾ�������йؿ�����������в���ȷ����

A��������ķ���ʽΪC9H8O4
B���������еĺ���������ֻ���Ȼ������ǻ�����
C����������Է���������Ӧ����ȥ��Ӧ��������Ӧ���Ӿ۷�Ӧ
D�� �ǿ������һ��ͬ���칹�壬1mol��������NaOH��Һ��Ӧʱ�������NaOH�����ʵ���Ϊ3 mol
�ǿ������һ��ͬ���칹�壬1mol��������NaOH��Һ��Ӧʱ�������NaOH�����ʵ���Ϊ3 mol
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com