
羟基磷灰石是一种重要的生物无机材料,其常用的制备方法有两种:
方法A:用浓氨水分别调Ca(NO3)2和(NH4)2HPO4溶液的pH约为12;在剧烈搅拌下,将(NH4)2HPO4溶液缓慢滴入Ca(NO3)2溶液中。
方法B:在剧烈搅拌下,将H3PO4溶液缓慢滴加到Ca(OH)2悬浊液中。
3种钙盐的溶解度随溶液pH的变化如图所示(图中纵坐标是钙离子浓度的对数),回答下列问题:
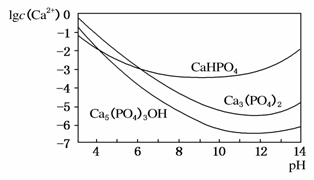
(1)完成方法A和方法B中制备Ca5(PO4)3OH的化学方程式:
①5Ca(NO3)2+3(NH4)2HPO4+4NH3·H2O===Ca5(PO4)3OH↓+____ _ ___+___ _____。
②5Ca(OH)2+3H3PO4===__________________ ____________。
(2)与方法A相比,方法B的优点是___________ ____________。
(3)方法B中,如果H3PO4溶液滴加过快,制得的产物不纯,其原因是_______________________________________________。
(4)图中所示3种钙盐在人体中最稳定的存在形式是________________(填化学式)。
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
已知:还原性HSO3¯>I¯,氧化性IO3¯> I2 。在含3 mol NaHSO3的溶液中逐滴加入KIO3
 溶液。加入KIO3和析出I2的物质的量的关系曲线如下图
溶液。加入KIO3和析出I2的物质的量的关系曲线如下图
所示。下列说法不正确的是
A.0~b间反应:3HSO3-+ IO3-= 3SO42-+ I-+ 3H+
B.a点时消耗NaHSO3的物质的量为1.2 mol
C.b~c间反应:I2仅是氧化产物
D.当溶液中I¯与I2的物质的量之比为5∶2时,加入的
KIO3 为1.08mol
查看答案和解析>>
科目:高中化学 来源: 题型:
H2S水溶液中存在电离平衡:H2S H++HS-和HS-
H++HS-和HS- H++S2-,关于H2S溶液下列说法正确的是( )
H++S2-,关于H2S溶液下列说法正确的是( )
A.加水,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,平衡向左移动,溶液pH增大
C.滴加新制氯水,平衡向左移动,溶液pH减小
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示。已知:pM=-lg c(M),p(CO )=-lg c(CO
)=-lg c(CO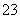 )。下列说法正确的是 ( )
)。下列说法正确的是 ( )
A.MgCO3、CaCO3、MnCO3的Ksp依次增大
B.a点可表示MnCO3的饱和溶液,且c(Mn2+) <c(CO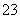 )
)
C.b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO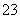 )
)
D.c点可表示MgCO3的不饱和溶液,且c(Mg2+)<c(CO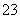 )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示,这四种元素原子的最外层电子数之和为20,下列判断正确的是
| W | X | Y |
| Z |
A. 四种元素的原子半径:rZ>rX>rY>rW
B. 四种元素形成的单质最多有6种
C. 四种元素均可与氢元素形成电子总数为18的分子
D. 四种元素中,Z的最高价氧化物对应的水化物酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品。
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是 (填序号)。
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾、溴、镁的提取工艺
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收。碱吸收溴的主要反应是Br2+Na2CO3+H2O  NaBr + NaBrO3+NaHCO3,吸收1mol Br2时,转移的电子数为 mol。
NaBr + NaBrO3+NaHCO3,吸收1mol Br2时,转移的电子数为 mol。
(3)海水提镁的一段工艺流程如下图:
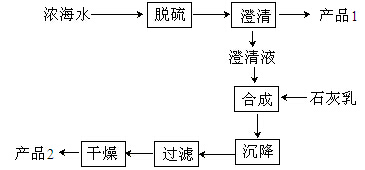
浓海水的主要成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/g/L | 63.7 | 28.8 | 144.6 | 46.4 |
该工艺过程中,脱硫阶段主要反应的离子方程式为 ,产品2的化学式为 ,1L浓海水最多可得到产品2的质量为 g。
(4)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为 ;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应可视为旧键短裂和新键形成的过程。共价键的键能是两种原子间形成1mol共价键(或其可逆过程)时释放(或吸收)的能量。已知H-H 键的键能为436kJ·mol-1 ,Cl-Cl键的键能为243 kJ·mol-1 ,H-Cl键的键能为431 kJ·mol-1 ,则H2 (g ) + Cl2 (g ) == 2HCl(g ) 的反应热(△H )等于( )
A.-183 kJ·mol-1 B.183 kJ·mol-1 C.-862 kJ·mol-1 D.862 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)= H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是
A.H2(g)的燃烧热为571.6 kJ·mol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.1/2H2SO4(aq)+1/2Ba(OH)2(aq)=1/2BaSO4(s)+H2O(l)ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com