
I���� K2Cr2O7+14HCl�T2KCl+2CrCl3+3Cl2��+7H2O��Ӧ�У�
��1�� Ԫ�ر������� ����������
��2���ڸ÷�Ӧ������0.5mol K2Cr2O7����ԭ����������HCl�����ʵ���Ϊ mol��
�����ۡ�ͭ�ۡ��Ȼ�����Һ���Ȼ�������Һ���Ȼ�ͭ��Һ��������ݻ����ʵ��ձ��ڣ���ַ�Ӧ������д���пհף�
��1����������ʣ�࣬����Һ�в������е������� ����Fe3+��Cu2+��Fe2+��ѡ���
��2������Һ���Ȼ������Ȼ�ͭ����ʣ�࣬�����еĽ��������� ����Fe��Cu��ѡ���
 ��1����Ԫ�¿�������ĩϵ�д�
��1����Ԫ�¿�������ĩϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ӱ���ˮ������ѧ�߶����¿�����ѧ�Ծ��������棩 ���ͣ�ѡ����
��ͼװ���У�С�Թ���Ϊ��īˮ������֧�ܵ�U����ʢ��pH��4����ˮ������Ƭ�����۲죬װ��������������ʼʱ����С�Թ��еĵ����ڵ�Һ���½���һ��ʱ����ڵ�Һ��������Ը���U ���е�Һ�档�����йؽ��ͺ������ǣ� ��
���е�Һ�档�����йؽ��ͺ������ǣ� ��
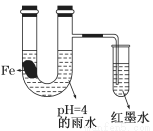
A������Ƭ�е�̼��ԭ��صĸ�����������ԭ��Ӧ
B����ˮ���Խ�ǿ������Ƭʼ�շ������ⸯʴ
C��īˮҺ�����ʱ��������ӦʽΪ��O2��2H2O��4e����4OH��
D��U������ҺpH��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ��һ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪���м�����Ӧ�Ļ�ѧ����ʽ��
��2KI��Cl2=2KCl��I2��
��2FeCl2��Cl2=2FeCl3��
��2FeCl3��2HI=2FeCl2��I2��2HCl��
��I2��SO2��2H2O=H2SO4��2HI�������й����ʵ������Ե�ǿ������˳������ȷ����
A��Cl2��Fe3����I2��SO2 B��Cl2��I2��Fe3����SO2
C��Cl2��Fe3����SO2��I2 D��Fe3����I2��Cl2��SO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ������ʡ�߶���10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��һ���¶��µĺ����ܱ������У����������������ٷ����仯ʱ��������ӦA(s)��3B(g) 2C(g)��D(g)�Ѵ�ƽ��״̬����
2C(g)��D(g)�Ѵ�ƽ��״̬����
�ٻ�������ѹǿ �ڻ��������ܶ� ��B�����ʵ���Ũ�� ������������ʵ��� �ݻ�������ƽ����Է�������
A���٢ڢ� B���٢ܢ� C���٢ۢ� D���ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ������ʡ�߶���10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪H2SO4(aq)��Ba(OH)2(aq)��Ӧ�Ħ�H����1584.2 kJ��mol��1��HCl(aq)��NaOH(aq)��Ӧ�Ħ�H����55.6 kJ��mol��1��������BaSO4(s)�ķ�Ӧ�ȵ���
A����1528.6 kJ��mol��1 B����1528.6 kJ��mol��1
C����1473 kJ��mol��1 D����1473 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ��һ��ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���б仯��Ҫ��������������ʵ�ֵ���
A.CaCO3 �� CO2 B.KMnO4�� O2 C.HCl �� Cl2 D.H2SO4 �� H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ���Ĵ��ɶ����и߶���12���¿���ѧ�Ծ��������棩 ���ͣ������
��֪����̼���Ƶı�����Һ�ڲ�ͬ�¶���������������ͼ��ʾ��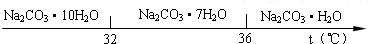
��25��ʱ�й����ʵ��ܶȻ����£�
���� | CaCO3 | MgCO3 | Ca��OH��2 | Mg��OH��2 | Fe ��OH��3 |
Ksp | 4.96��10-9 | 6.82��10-6 | 4.68��10-6 | 5.61��10-12 | 2.64��10-39 |
��ҵ̼���ƣ�����ԼΪ98%���к���Ca2+��Mg2+��Fe3+��Cl-��SO42-�����ʣ��ᴿ������·���£�
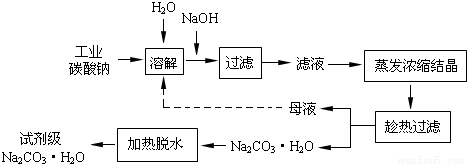
��1������NaOH��Һʱ����Ӧ�����ӷ���ʽΪ__________________��
��2������Mg2+��Fe3+����Һ�еμ�NaOH��Һ�������ֳ�����������Һ��pH=8ʱ��c��Mg2+����c��Fe3+��= ___________��
��3����ĸҺ���г��˺���Na+��CO32-�⣬������_________�����ӡ�
��4�����˴ӡ���ɫ��ѧ���Ƕ����뽫��ĸҺ����������������ʾ����ѭ��ʹ�á��������ʵ�ʹ�ҵ�������Ƿ����_________������С������С�������˵������__________________��
��5����֪��Na2CO3•10H2O(s)=Na2CO3(s)+10H2O(g)��H=+532.36kJ•mol-1
Na2CO3•10H2O(s)=Na2CO3•H2O(s)+9H2O(g) ��H=+473.63kJ•mol-1
д��Na2CO3•H2O��ˮ��Ӧ���Ȼ�ѧ����ʽ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ������ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
ij��Դװ����ͼ��ʾ������ܷ�ӦʽΪ��2Ag+Cl2===2AgCl������˵����ȷ����
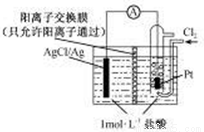
A��������ӦΪAgCl+e-�TAg+Cl-
B���ŵ�ʱ������Ĥ�Ҳ���Һ���д�����ɫ��������
C������NaCl��Һ�������ᣬ�����ܷ�Ӧ��֮�ı�
D������·��ת��0.01mol e-ʱ������Ĥ������Һ��Լ����0.02mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016������ʡ������ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�״����ӽ���Ĥȼ�ϵ���н��״�����ת��Ϊ���������ַ�Ӧԭ���ǣ� ��
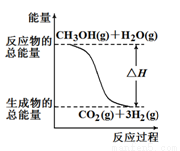
��CH3OH(g)��H2O(g)��CO2(g)��3H2(g) ��H ����49.0 kJ/mol
��CH3OH(g)��1/2O2(g)��CO2(g)��2H2(g) ��H����192.9 kJ/mol
����������Ӧ������˵����ȷ����
A����ͼ��ʾ��Ӧ���е������仯
B������֪2H2(g)��O2(g)��2H2O(g) ?��H����483.8 kJ/mol
C��1 mol CH3OH���ȼ�շų�������Ϊ192.9 kJ
D��CH3OHת���H2�Ĺ���һ��Ҫ��������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com