
【题目】(1)在标准状况下,33.6LN2的物质的量为_____mol,其分子数为_______。
(2)0.4mol某气体的体积为9.8L,则该气体的摩尔体积为____,气体所处的条件____(填“是”或者“不是”)标准状况。
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1 CH3COOH溶液所得滴定曲线如下图。下列说法正确的是

A. 点①所示溶液中:c(CH3COO-)+c(OH-)=c(Na+)+c(H+)
B. 点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)
C. 点③所示溶液中:NaOH与CH3COOH恰好完全中和,溶液呈中性
D. 在0.1000 mol·L-1 CH3COOH溶液中,由水电离出来的c(H+)= 10-13 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能电池的发展趋向于微型化、薄膜化。最新产品是铜镓(Ga)硒(Se)等化合物薄膜太阳能电池和Si系薄膜太阳能电池。完成下列填空:
(1)Cu+基态时的电子排布式_________;1mol配合离子[Cu(NH3)2]+ 中,含有σ键数目为__________。
(2)已知硼元素与镓元素处于同一主族,BF3分子的空间构型为_____。
(3)与硒同周期相邻的元素为砷和溴,则这三种元素的第一电离能从大到小顺序为_______(用元素符号表示),H2Se的沸点比H2O的沸点低,其原因是___________。
(4)单晶硅的结构与金刚石结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子不成键,则得如图所示的金刚砂结构;在晶体中,每个Si原子周围最近的C原子数目为_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小王同学准备用CuSO4·5H2O配制500mL0.1mol·L-1CuSO4溶液。
(1)小王同学选用的容量瓶规格为_______mL。
(2)玻璃棒在该实验中有重要的用途,分别是________ 和__________。
(3)小王同学通过计算,用托盘天平称取_________ gCuSO4·5H2O。
(4)有关物质的量浓度的误差分析(填“偏高”、“偏低”或“无影响”):①若容量瓶洗净未为干燥,残留少量水分,则所配制溶液的浓度将__________。②定容时,若俯视刻度线,则所配制的溶液浓度将__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮、氧、氟、钙、铜等元素的化合物广泛存在于自然界,回答下列问题:
(1)将乙炔(C2H2)通入[Cu(NH3)2]Cl溶液生成Cu2C2红榇色沉淀。乙炔分子中σ键与π键个数比值为___________,Cu+基态核外电子排布式为___________,[Cu(NH3)2]Cl中化学键类型为___________。
(2)NF3是微电子工业中优良的等离子刻蚀气体。元素第一电离能N___________F(填“>”“<”或“=”),NF3中氮原子的杂化轨道类型为___________,NF3属于___________分子。(填“极性”或“非极性”)
(3)C60可以用作储氢材料。已知金刚石中C-C的键长为154.45pm,C60中C-C的键长为140~145pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确?理由是___________。
(4)氮的氧化物和含氧酸在医疗上具有重要的应用。写出与N2O互为等电子体的分子___________(任写一种),酸性HNO3>HNO2,试着从结构上解释其原因___________。
(5)电石(CaC2)是有机合成化学工业的基本原料。CaC2晶体的晶胞结构与NaCl晶体相似(如图所示),但晶体中由于哑铃形C22-的存在,使晶胞沿一个方向拉长。CaC2晶体中每个Ca2+周围距离最近的C22-的数目为___________,已知CaC2晶体的密度为2.22g·cm-3,该晶胞的体积为___________cm3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐是优良的多功能水处理剂。某实验小组釆用如图装置制备高铁酸钾(K2FeO4)并探究其性质用途。

Ⅰ.制备K2FeO4(夹持、加热等装置略)

(1)B中所用试剂为______________________。
(2)C中反应为放热反应,而反应温度须控制在0~8℃,可使用的控温方法为___________,充分反应后得到紫色固体,反应方程式为___________。反应中KOH必须过量的原因是___________。
(3)C中混合物经过滤、洗涤、干燥,得纯浄髙铁酸钾晶体,洗涤时洗涤剂可选用___________。
a.冰水 b.KOH溶液 c.异丙醇
Ⅱ.探究K2FeO4的性质
(4)K2FeO4可以将废水中的CN-氧化为CNO-,实验表明,pH=9时CN-去除效果最佳。配平反应离子方程式:____FeO42-+____CN-+____H2O→____Fe(OH)3↓+____CNO-+___OH-。
现处理含CN-离子浓度为13mg/L的废水1m3,至少需要K2FeO4___________g。
(5)资料表明,酸性溶液中氧化性FeO42->MnO4-。验证实验:将少K2FeO4溶解在过量KOH溶液中,溶液呈浅紫色,取该溶液滴入MnSO4和H2SO4的混合溶液中,振荡,溶液颜色仍然呈浅紫色。请设计实验证明最后所得浅紫色溶液中含有MnO4-___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,有pH值为12的NaOH溶液100 mL,欲将其pH值变为11,采取下列三种措施(设混合后溶液的体积等于两混合溶液体积之和)。请回答有关问题:
①若加水,应加入约________ mL。
②若用pH=10的NaOH溶液,应加入此NaOH溶液________ mL。
③若用pH=2的盐酸,应加入________ mL。
(2)pH=2的HA、HB两种酸溶液各1mL,分别加水稀释到1000mL, 其pH的变化如图所示

①稀释前两溶液的浓度c(HA)________c(HB)(填>.<.=,或无法确定)
② HB _______ 是弱酸 (填“一定”、“可能”或“一定不”)
③若 a = 5,则HA酸是否是强酸 ____(填“一定是”、“可能是”、 “一定不是”或“无法确定”)
④稀释后的溶液中,由水电离产生的c(H+): HA中_____ HB中(填>.<.=,或无法确定)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,加入2molA和1molB发生如下反应:2A(g)+B(?)![]() 2C(g)+D(g),C的体积分数(C%) 随时间的变化趋势符合右下图关系:下列说法正确的是( )
2C(g)+D(g),C的体积分数(C%) 随时间的变化趋势符合右下图关系:下列说法正确的是( )
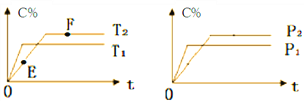
A. E点的v(逆)大于F点的v(正)
B. 若在F点时给容器加压,达新平衡时C的浓度将增大
C. 若给容器加热,该反应的平衡常数K将增大
D. 恒温恒容下达平衡后,向容器中再加入2molA和1molB,A的转化率不发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氯水性质的描述中不正确的是
A. 观察氯水的颜色,发现氯水呈黄绿色,说明氯水中存在Cl2
B. 向氯水中滴入碳酸钠溶液,有气体生成,说明氯水中存在H+
C. 向氯水中滴加硝酸银溶液,有白色沉淀生成,说明氯水中存在Cl-
D. 氯水经光照后,颜色逐渐消失并放出气体,导致溶液的酸性减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com