

分析 (1)装置a 在稀H2SO4溶液中,镁比铝活泼,铝电极作正极;
(2)在NaOH溶液中,铝比镁活泼,铝电极作负极;
(3)在浓硝酸中,铁被钝化,铁电极作正极,正极上发生NO3-的还原反应,产生气泡;装置d相当于金属铁发生吸氧腐蚀,铜电极作正极,铁是负极,负极上发生失电子的氧化反应.
解答 解:(1)装置a 在稀H2SO4溶液中,镁比铝活泼,铝电极作正极,正极的电极反应式为2H++2e-═H2↑,故答案为:2H++2e-═H2↑;
(2)在NaOH溶液中,铝比镁活泼,铝电极作负极,负极的电极反应式为Al-3e-+4OH-═AlO2-+2H2O,镁是正极,电极反应式为:6H2O+6e-=3H2↑+6OH-或 2H2O+2e-=H2↑+2OH-,故答案为:2H++2e-═H2↑;Al-3e-+4OH-═AlO2-+2H2O;
(3)在浓硝酸中,铁被钝化,铁电极作正极,正极上发生NO3-的还原反应,产生气泡,装置d相当于金属铁发生吸氧腐蚀,铜电极作正极,铁是负极,发生失电子的氧化反应,电极反应为:Fe-2e-=Fe2+,铜是正极发生的电极反应式为:O2+4e-+2H2O=4OH-,故答案为:铁;O2+4e-+2H2O=4OH-.
点评 本题综合考查原电池知识,侧重于学生的分析能力的考查,为高考常见题型和高频考点,注意把握原电池的工作原理,答题时注意体会电极方程式的书写方法,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
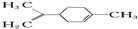 有关柠檬烯的分析正确的是( )
有关柠檬烯的分析正确的是( )| A. | 它的一氯代物有6种 | |
| B. | 它和丁基苯( 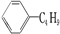 )互为同分异构体 )互为同分异构体 | |
| C. | 它的分子中所有的碳原子一定在同一平面上 | |
| D. | 一定条件下,它分别可以发生加成、取代、氧化、还原等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 | 30% H2O2 | 15% H2O2 | 10% H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| 有催化剂、不加热 | 10 | 25 | 60 | 120 |
| 实验操作 | MnO2状态 | 观察结果 | 反应所需时间 |
| 将MnO2加入5mL5%过氧化氢溶液中,不震荡 | 粉末状 | 剧烈反应,带火星的木条复燃 | 3.5分钟 |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硼及其化合物在工业上有许多用途.工业上以铁硼矿为原料制备硼酸,铁硼矿含有Mg、Fe、Ca、Al、B、O等多种元素,它的主要成分为Mg2B2O5•H2O和Fe3O4.
硼及其化合物在工业上有许多用途.工业上以铁硼矿为原料制备硼酸,铁硼矿含有Mg、Fe、Ca、Al、B、O等多种元素,它的主要成分为Mg2B2O5•H2O和Fe3O4.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10种 | B. | 12种 | C. | 14种 | D. | 16种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com