
汽车的启动电源常用铅蓄电池,放电时的电池反应如下:PbO2 +Pb+2H2SO4= 2PbSO4+2H2O,根据此反应判断下列叙述中正确的是
A.PbO2是电池的负极
B.负极的电极反应式为:Pb+SO42--2e– = PbSO4
C.PbO2得电子,被氧化
D.电池放电时,溶液酸性增强
科目:高中化学 来源: 题型:
某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等.水垢会形成安全隐患,需及时清洗除去.清洗流程如下:
Ⅰ.加入NaOH 和 Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸和少量NaF溶液,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉.
(资料在线:K3[Fe(CN)6]溶液遇亚铁盐会生成蓝色沉淀.)
(1)用NaOH溶解二氧化硅的化学方程式是 .
(2)在步骤Ⅱ中:
①被除掉的水垢除铁锈外,还有 .
②清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因 .
(3)步骤Ⅲ中,加入Na2SO3的目的是 .
(4)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe3O4保护膜.
①完成并配平其反应的离子方程式:
Fe+ NO2+ H2O═ N2↑+ +
②钝化效果的检测一般可用滤纸浸渍配好的检测液后贴附于待测样品表面或直接将溶液涂、滴于待测表面.下面检测钝化效果的方法合理的是 .
a.在炉面上滴加浓H2SO4,观察溶液出现棕黄色的时间
b.在炉面上滴加酸性CuSO4溶液,观察蓝色消失的时间
c.在炉面上滴加浓HNO3,观察出现红棕色气体的时间
d.在炉面上滴加酸性K3[Fe(CN)6]溶液,观察出现蓝色沉淀的时间.
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器容积扩大一倍,当达到新的平衡时,B的浓度变为原来的60%,则
bB(g)达平衡后,保持温度不变,将容器容积扩大一倍,当达到新的平衡时,B的浓度变为原来的60%,则
A.平衡向正反应方向移动了 B.物质A的转化率减小了
C.物质B的质量分数减小了 D.a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应所得溶液中一定只含一种溶质的是
A.向NaOH溶液中通入CO2 B.向Ca(OH)2溶液中通入Cl2
C.向蒸馏水中加入少量金属Na D.向MgSO4溶液中滴入NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
正确表示下列反应的离子反应方程式为
A.NH4HCO3溶于过量的浓KOH溶液中并加热:NH4++ HCO3-+2OH-△CO32-+ NH3↑+2 H2O
B.Fe溶于硝酸:Fe+2H+﹦Fe2++H2↑
C.向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO42-=BaSO4↓
D.醋酸除去水垢:2H++CaCO3=Ca2++ CO2↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E五种短周期元素,A 与D同周期,A的单质既可与盐酸反应,又可与NaOH溶液反应,B的单质在放电条件下能与氧气反应,C元素的离子不含电子,D元素原子的最外层电子数是其次外层电子数的3/4,E元素原子的最外层电子数是其次外层电子数的3倍。
(1)A的原子结构示意图为 。
(2)0.1 mol/L A的硫酸盐溶液与0.1 mol/L NaOH溶液等体积混合,反应的离子
方程式为 。
(3)以A的单质和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池总反应的化学方程式是 。
(4)化合物甲由元素A、B组成,具有良好电绝缘性。
化合物甲能与水缓慢反应生成含B的化合物乙,乙分子中含有10个电子。写出该反应的化学方程式: 。
工业用A的单质和化合物乙在高于1700K反应制备甲。已知该反应可以认为是置换反应,该反应的化学方程式是 。
(5)D和E两种元素相比较,非金属性较强的是(填元素名称) ,可以验证该结论的是(填写编号) ;
a.比较这两种元素的常见单质的沸点
b.比较这两种元素的单质与氢气化合的难易
c.比较这两种元素的气态氢化物的稳定性
(6)C、D、E间可形成丙、丁两种分子,它们均含有18个电子,则丙与丁反应生成D单质的化学方程式为 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于有机化合物的认识不正确的是
A.油脂在空气中完全燃烧转化为水和二氧化碳
B.蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体
C.在水溶液里,乙酸分子中的—CH3可以电离出H+
D.在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
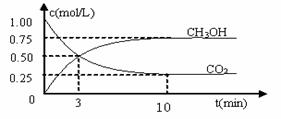
①反应开始到平衡,H2的平均反应速率v(H2)=_________________mol/(L·min),
②H2的转化率为 ______ ______ 。
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A、升高温度 B、充入He(g),使体系压强增大
C、将H2O(g)从体系中分离 D、再充入1mol CO2和3mol H2
E、使用催化剂 F、缩小容器体积
(2)①反应进行到3 min时,同种物质的v正 与v逆的关系: v正 v逆 (填>,=,<)
②上述反应平衡常数的表达式为 ,
经计算该温度下此反应平衡常数的数值为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是
A.钠和水的反应:Na + H2O = Na+ + OH- + H2↑
B.氯化铝溶液中加入过量氨水:Al3+ + 3NH3?H2O = Al(OH)3↓+ 3NH4+
C.铁粉加入稀硫酸中:2Fe + 6H+ = 2Fe3+ + 3H2↑
D.氢氧化钡溶液跟稀硫酸反应:Ba2+ + OH- + H++ SO42- = BaSO4↓+ H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com