
【题目】室温下,用0.1000molL-1NaOH溶液滴定20mL0.1000molL-1H3PO4溶液,溶液的pH与所加NaOH溶液的体积关系如图所示。下列说法不正确的是( )

A.H3PO4的电离平衡常数Ka1约为10-2
B.当V(NaOH溶液)=40mL时,c(PO![]() )+c(OH-)=c(H+)+c(H2PO
)+c(OH-)=c(H+)+c(H2PO![]() )+2c(H3PO4)
)+2c(H3PO4)
C.当pH=7时,c(Na+)=c(H2PO![]() )+2c(HPO
)+2c(HPO![]() )+3c(PO
)+3c(PO![]() )
)
D.当V(NaOH溶液)=20mL时,c(Na+)>c(H2PO![]() )>c(H3PO4)>c(HPO
)>c(H3PO4)>c(HPO![]() )
)
【答案】D
【解析】
0.1000molL-1NaOH溶液滴定20mL0.1000molL-1H3PO4溶液,由图像可知,加入NaOH溶液的体积为20mL时,pH=4.7,溶液中的溶质主要为NaH2PO4,加入NaOH溶液的体积为40mL时,pH=9.7,溶液中的溶质主要为Na2HPO4,据此结合三大守恒分析解答问题。
A.根据图像分析可知,未加入NaOH溶液时,H3PO4溶液的pH=1.6,则H3PO4的电离平衡常数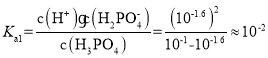 ,A选项正确;
,A选项正确;
B.当V(NaOH溶液)=40mL时,溶液中的溶质主要为Na2HPO4,则存在物料守恒c(Na+)=2c(PO![]() )+2c(HPO
)+2c(HPO![]() )+2c(H2PO
)+2c(H2PO![]() )+2c(H3PO4),电荷守恒有c(Na+)+c(H+)=3c(PO
)+2c(H3PO4),电荷守恒有c(Na+)+c(H+)=3c(PO![]() )+2c(HPO
)+2c(HPO![]() )+c(H2PO
)+c(H2PO![]() )+c(OH-),两式相减有c(PO
)+c(OH-),两式相减有c(PO![]() )+c(OH-)=c(H+)+c(H2PO
)+c(OH-)=c(H+)+c(H2PO![]() )+2c(H3PO4),B选项正确;
)+2c(H3PO4),B选项正确;
C.pH=7时,c(H+)=c(OH-),又存在电荷守恒:c(Na+)+c(H+)=3c(PO![]() )+2c(HPO
)+2c(HPO![]() )+c(H2PO
)+c(H2PO![]() )+c(OH-),所以c(Na+)=c(H2PO
)+c(OH-),所以c(Na+)=c(H2PO![]() )+2c(HPO
)+2c(HPO![]() )+3c(PO
)+3c(PO![]() ),C选项正确;
),C选项正确;
D.当V(NaOH溶液)=20mL时,溶液中的溶质为NaH2PO4,pH=4.7,溶液显酸性,则H2PO![]() 电离大于水解,因此c(HPO
电离大于水解,因此c(HPO![]() )>c(H3PO4),D选项错误;
)>c(H3PO4),D选项错误;
答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在500℃时,将4molSO2与2molO2放入4L的密闭容器中,5分钟后反应达到平衡:2SO2+O2![]() 2SO3,测得平衡时SO3的浓度为0.5mol·L-1。
2SO3,测得平衡时SO3的浓度为0.5mol·L-1。
(1)在500℃时,该反应平衡常数K=_____
(2)反应达到平衡时,SO2的转化率为______
(3)从开始反应至达到平衡状态 反应速率v(O2)=_____
(4)该反应在低温时能自发进行,则该反应的正反应是_____(填“放热”或“吸热”)反应
(5)在500℃时,在2L的密闭容器中,发生上述反应,某一时刻测得容器内SO2、O2、SO3的物质的量分别为1mol、2mol、2mol则此时正逆反应速率大小为v(正)____v(逆)(填“>”“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)![]() B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
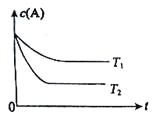
(1)上述反应的温度T1___ T2,平衡常数K(T1)___K(T2)。(填“大于”、“小于” 或“等于”)
(2)若温度T2时,5min后反应达到平衡,A的转化率为70%,则:
①平衡时体系总的物质的量为_______。
②反应的平衡常数K=______。
③反应在0~5min区间的平均反应速率v(A)=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g),在一可变容积的密闭容器中进行,下列条件改变对其反应速率几乎无影响的是( )
CO(g)+H2(g),在一可变容积的密闭容器中进行,下列条件改变对其反应速率几乎无影响的是( )
A. 体积不变,充入氮气使压强增大 B. 体积缩小一半
C. 压强不变,充入氮气使体积增大 D. 升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学课上围绕浓硫酸的化学性质进行如下实验探究,将适量的蔗糖放入烧杯中,加几滴水,搅拌均匀,然后加入浓硫酸,生成黑色物质。请回答下列问题:
(1)生成的这种黑色物质(单质)是(填化学式)____________________。
(2)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的污染物之一,这种刺激性气味气体为(填化学式)_________,反应的化学方程式为________。
(3)根据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有(填字母) _______。
A.酸性 B.吸水性
C.脱水性 D.强氧化性
(4)将(2)中产生的有刺激性气味的气体通入品红溶液中,可以看到品红溶液_______,说明这种气体有______性;将(2)中产生的有刺激性气味的气体通入氯水中,发生反应的化学方程式为_______。
(5)能否用澄清石灰水鉴别(2)中产生的两种气体 (填“能”或“不能”)________,若不能,请写出两种可以鉴别这两种气体的试剂:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有氯化钠和碘化钠的混合物共26.7 g,溶于水,通入足量氯气后,蒸干、灼烧,固体质量变为 17.55 g。
(1)原混合物中碘化钠的质量是________。
(2)原混合物中氯化钠的质量分数是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组分析了用硫铁矿烧渣(主要成份Fe2O3、Fe3O4、FeO等)制备铁红(Fe2O3)的流程图并进行了铁红性质实验。
(一)铁红制备的流程图
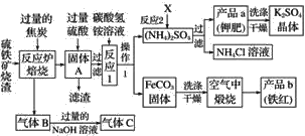
(1)写出焙烧中一氧化碳与氧化铁反应的化学方程式:______________________。
(2)实验室完成操作1,用到的玻璃仪器有烧杯、玻璃棒和____________(填仪器名称)。
(3)你认为对气体C最佳的处理方法是________(填选项序号)。
A.冷却后排入空气
B.燃烧后排放
C.再通入反应炉
(4)反应1的反应温度一般需控制在35 ℃以下,其目的是______________________________。
(5)反应2中相关物质的溶解度如表,你认为该反应在常温下能实现的原因是:_____。
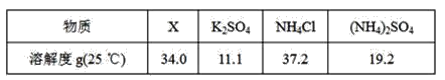
洗涤干燥得到硫酸钾晶体时,可选用下列______(选填序号,下同)洗涤剂
A.氯化钾饱和溶液
B.水
C.硫酸钾饱和溶液
为检验硫酸钾晶体是否洗涤干净,可取最后一次洗涤液,先加入________,振荡、静置,再向上层清液中滴加________,观察现象即可判断。
A.硝酸银溶液
B.过量的氯化钡溶液
C.过量的硝酸钡溶液
(二)铁红的性质实验
(1)实验装置
已知:草酸晶体(H2C2O4·3H2O)在浓H2SO4作用下受热分解,化学方程式为H2C2O4·3H2O![]() CO2↑+CO↑+4H2O
CO2↑+CO↑+4H2O
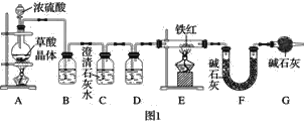
①实验前应先______________________。
②进入E中的气体是纯净、干燥的一氧化碳,则B、D中的试剂依次是______、______(填字母编号)。
A.浓硫酸
B.澄清的石灰水
C.氢氧化钠溶液
③C装置的作用是________________________________。
(2)数据分析与计算:
用SDTQ600热分析仪对氧化铁和一氧化碳进行热反应分析,获得相关数据,绘制成管内剩余固体质量与反应温度的关系如图2。

已知铁的氧化物有FeO、Fe3O、Fe2O3,在一定的条件下,都能够逐步失去其中的氧,最终被还原为铁。
①800 ℃以上时,管内固体成分的化学式为___________。
②写出管内固体质量由48 g变为46.4 g时反应的化学方程式:________________________。
(3)实验评价
请指出问题讨论中实验装置的一个明显缺陷:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用电解熔融氧化铝来制取金属铝,关于该反应的下列说法不正确的是
A.属于分解反应
B.属于氧化还原反应
C.金属铝是氧化产物
D.说明氧化铝是电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com