
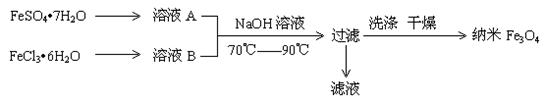
 O 和 FeCl3·6H2O的物质的量之比最好应为 ,在此条件下,检验铁元素是否沉淀完全的实验操作是 。
O 和 FeCl3·6H2O的物质的量之比最好应为 ,在此条件下,检验铁元素是否沉淀完全的实验操作是 。| A.纳米Fe3O4磁硫体分散系属于溶液。 |
B.纳米Fe3O4磁硫体可 以通过渗析法得到提纯。 以通过渗析法得到提纯。 |
| C.当一束可见光通过该磁硫体时会出现光亮的通路。 |
| D.纳米Fe3O4磁硫体比较稳定。 |
科目:高中化学 来源:不详 题型:填空题
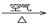 CuO
CuO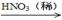 Cu(NO3)2
Cu(NO3)2 | A.40.32L | B.30.24L | C.20.16L | D.13.44L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H2O。
H2O。 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是________kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)
kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是________kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.所得沉淀为0.05 mol的BaSO4 | B.混合气体中SO2的体积为0.448 L |
| C.a L混合气体的物质的量为0.04 mol | D.a的取值范围为0.672<a<0.896 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.56(3x+y)g | B.56(3x-y) g | C.28(3x+y)g | D.28(3x-y)g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.称取15.2g硫酸铜固体,加入1000 mL水 |
B.称取2 4g胆矾溶于水配成1000 mL溶液 4g胆矾溶于水配成1000 mL溶液 |
| C.称取16 g硫酸铜固体,加入1000 mL水 |
| D.称取25 g胆矾溶于水配成1000 mL溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com