
分析 (1)氯气和水反应生成具有杀菌作用的物质是次氯酸;氯离子的检验滴加硝酸酸化的AgNO3溶液,有白色沉淀产生;
(2)氯气与NaOH溶液反应生成NaCl、NaClO和水;氧化剂是氯气,1mol氯气发生反应,转移电子的物质的量为1mol,消毒液中的有效成分是次氯酸钠;
(3)氯水中次氯酸见光分解,而消毒液稳定.
解答 解:(1)氯气和水反应生成具有杀菌作用的物质是次氯酸;氯离子的检验滴加硝酸酸化的AgNO3溶液,有白色沉淀产生,说明溶液中存在氯离子,故答案为:HClO(或次氯酸);取少量自来水,向其中滴加硝酸酸化的AgNO3溶液,有白色沉淀产生;
(2)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应为Cl2+2NaOH=NaCl+NaClO+H2O,氧化剂是氯气,1mol氯气发生反应,转移电子的物质的量为1mol,消毒液中的有效成分是次氯酸钠,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;氯气;1;次氯酸钠;
(3)氯水中次氯酸见光分解,而消毒液稳定,故答案为:次氯酸不稳定,见光易分解.
点评 本题考查较为综合,涉及氯气的性质以及检验等题目,难度中等,学习中注意相关基础知识的积累.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
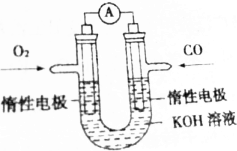 某实验小组将反应2CO(g)+O2(g)═2CO2(g)设计成如图所示的电池装置,负极的电极反应式为CO-2e-+2OH-=CO32-+H2O;正极的电极反应式为O2+2H2O+4e-=4OH-.电池工作时,正极区域溶液的pH变大(填“变大”“变小”或“不变”)用该原电池做电源,电解200mL饱和食盐水(足量),消耗的标准状况下的CO224mL,则溶液的pH=13.(不考虑溶液体积的变化)
某实验小组将反应2CO(g)+O2(g)═2CO2(g)设计成如图所示的电池装置,负极的电极反应式为CO-2e-+2OH-=CO32-+H2O;正极的电极反应式为O2+2H2O+4e-=4OH-.电池工作时,正极区域溶液的pH变大(填“变大”“变小”或“不变”)用该原电池做电源,电解200mL饱和食盐水(足量),消耗的标准状况下的CO224mL,则溶液的pH=13.(不考虑溶液体积的变化)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
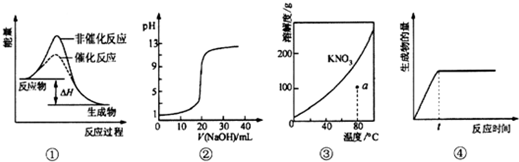
| A. | ①表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| B. | ②表示0.1 mo1•L-1NaOH溶液滴定20 mL 0.1 mo1•L-1HCl溶液所得到的滴定曲线 | |
| C. | ③表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 | |
| D. | 某可逆反应生成物的量随反应时间关系如图④所示,在t时反应物转化率达到最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
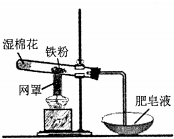
| A. | 该反应属于复分解反应 | |
| B. | 网罩的作用是集中火焰,提高温度 | |
| C. | 湿棉花的作用是给试管降温,防止炸裂 | |
| D. | 反应中水既不是氧化剂,也不是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4 | B. | KAl(SO4)2 12H2O | C. | C2H5OH | D. | Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗硅制备单晶硅不涉及氧化还原反应 | |
| B. | 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位 | |
| C. | 硅的化学性质不活泼,在自然界中可以以游离态存在 | |
| D. | 硅在电子工业中,是重要的半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
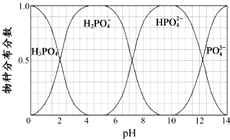 磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示.
磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 95℃纯水的pH<7,说明加热可导致水呈酸性 | |
| B. | 用pH试纸测溶液的pH时,需先用蒸馏水润湿试纸 | |
| C. | 0.2 mol/L的盐酸与等体积水混合后pH约为1 | |
| D. | 25℃时,pH=12的氨水溶液与pH=2的盐酸等体积混合后pH=7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com