
镭是元素周期表中第七周期第ⅡA族元素,关于其叙述不正确的是( )
A. 镭的金属性比钙弱 B. 单质能与水反应生成H2
C. 在化合物中呈+2价 D. 碳酸镭难溶于水
考点: 元素周期律和元素周期表的综合应用.
专题: 元素周期律与元素周期表专题.
分析: 镭是元素周期表中第七周期第IIA族元素,与Mg、Ca等金属位于同一主族,性质相似,根据元素周期律的性质规律推断镭对应的单质以及化合物的性质.
解答: 解:镭是元素周期表中第七周期第IIA族元素,与Mg、Ca等金属位于同一主族,性质相似,则
A.同主族元素从上到下元素的金属性逐渐增强,故A错误;
B.镭单质性质活泼,能与水发生反应生成氢气,故B正确;
C.第IIA族元素最外层有2个电子,化合价为+2价,故C正确;
D.同主族元素对应的单质或化合物的性质具有相似性,根据碳酸镁、碳酸钙的性质可知,碳酸镭难溶于水,故D正确.
故选A.
点评: 本题考查元素周期表与周期律的综合应用,题目难度不大,注意根据周期律的递变规律推断元素可能具有的性质.


科目:高中化学 来源: 题型:
有一瓶澄清的溶液,可能含NH4+、K+、Na +、Mg2+、Ba2+、Al3+、Fe3+、SO42﹣、CO32﹣、Cl﹣、I﹣中的一种或几种,取该溶液进行如下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入少量CCl4及数滴新制的氯水,经振荡后静置,CCl4层呈紫红色;
(3)取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成;
(4)取部分上述呈碱性的溶液,加Na2CO3溶液,有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝.
根据上述实验事实确定并回答:在溶液中肯定存在的离子有 ,肯定不存在的离子有 ,还不能确定是否存在的离子有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是()
A. 在原电池的负极和电解池的阴极上都是发生失电子的氧化反应
B. 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2
C. 用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH
D. 电解精炼铜时,将粗铜作电解池的阴极,纯铜作电解池的阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
在相同条件下,分别将下列气体等体积混合于四支大小相同的试管中:①NO与NO2;②NO与O2;③NO2与O2;④SO2与NO2,将四支试管倒立于水中,各试管中水面上升高度应为( )
A. ①>②>③>④ B. ②>③>④>① C. ①=②=③=④ D. ③>②>①>④
查看答案和解析>>
科目:高中化学 来源: 题型:
足量的铝分别与等物质的量浓度的稀盐酸、氢氧化钠溶液反应,放出的气体在标准状况下体积相等,则所取稀盐酸和氢氧化钠溶液的体积比为( )
A. 3:1 B. 3:2 C. 1:2 D. 6:1
查看答案和解析>>
科目:高中化学 来源: 题型:
把含硫酸铵和硝酸铵的混合液a L分成两等份.一份加入含b mol NaOH的溶液并加热,恰好把NH3全部赶出;另一份需消耗c mol BaCl2才能使SO42﹣完全沉淀,则原溶液中NO3﹣的物质的量浓度为( )
A. 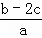 B.
B. 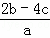 C.
C. 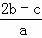 D.
D. 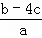
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与化学反应能量变化相关的叙述正确的是()
A. 生成物总能量一定低于反应物总能量
B. 放热反应的反应速率总是大于吸热反应的反应速率
C. 应用盖斯定律,可计算某些难以直接测量的反应焓变
D. 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1mol O═O键完全断裂时吸收热量496kJ,水蒸气中1mol H﹣O键形成时放出热量463kJ,则氢气中1mol H﹣H键断裂时吸收热量为()
A. 188kJ B. 436 kJ C. 557 kJ D. 920 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
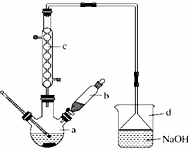
溴苯是一种化工原料,实验室合成溴体的装置示意图及有关数据如下:
苯 溴 溴苯
密度/g•cm﹣3 0.88 3.10 1.50
沸点/℃ 80 59 156
水中溶解度 微溶 微溶 微溶
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白色烟雾产生,是因为生成了 气体.继续滴加至液溴滴完.装置d的作用是 ;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL 10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是 ;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是 ;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,下列操作中必须的是 ;(填入正确选项前的字母)
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是 .(填入正确选项前的字母)
A.25mL B.50mL C.250mL D.500mL.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com