
| 催化剂 |
| 高温高压 |
| 催化剂 |
| 高温高压 |
| 催化剂 |
| 高温高压 |
| 催化剂 |
| 高温高压 |
| 240g |
| 160g/mol |


科目:高中化学 来源: 题型:

 :
:| △ |
| △ |
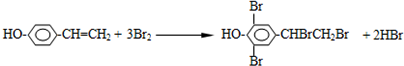





查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 4C(l)+2D(g).平衡时测得n(C)=1.6mol.下列说法正确的是( )
4C(l)+2D(g).平衡时测得n(C)=1.6mol.下列说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
 (2011?怀柔区模拟)甲、乙、丙、丁是由短周期元素组成的物质,反应如下:甲+乙→丙+丁
(2011?怀柔区模拟)甲、乙、丙、丁是由短周期元素组成的物质,反应如下:甲+乙→丙+丁| 2 | 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com