
【题目】某研究团队在优化催化剂的基础上,通过调节电极的孔道和疏水性增加CO的扩散速率,实现了高选择性将CO电解还原制备乙烯,如图所示。下列叙述错误的是( )
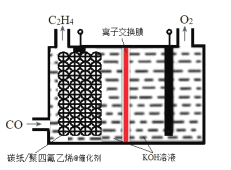
A.碳纸/聚四氟乙烯电极为阴极
B.聚四氟乙烯的作用是吸附并增加CO的浓度
C.为了维持电解的效率,离子交换膜应为阳离子交换膜
D.碳纸上生成C2H4的电极反应式为:2CO+6H2O+8e-=C2H4+8OH-
【答案】C
【解析】
A.根据装置示意图可知,CO在碳纸/聚四氟乙烯电极反应生成C2H4,碳元素化合价降低,得电子发生还原反应,则碳纸/聚四氟乙烯电极为阴极,A正确;
B.碳纸/聚四氟乙烯电极@催化剂为阴极,碳纸的作用为增强电极的导电性,聚四氟乙烯可以吸附CO,提高其在氢氧化钾溶液中的浓度,增大CO与催化剂的接触面积,B正确;
C.阴极反应生成氢氧根离子,阳极反应消耗氢氧根离子,电极反应式为4OH--4e-=2H2O+O2↑,为了维持电解质溶液导电能力的稳定,故离子交换膜应为阴离子交换膜,C错误;
D.电解质溶液呈碱性,CO在碳纸/聚四氟乙烯电极得电子生成C2H4和氢氧根离子,电极反应式为2CO+6H2O+8e-=C2H4+8OH-,D正确;
答案选C。


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
I.2015年国产C919大型客机正式下线,标志着我国成为世界上少数几个具有自行研制大型飞机的国家之一,标志着我国航空工业进入了新的发展阶段。
(1)飞机的外壳通常采用镁-铝合金材料,铝的价电子排布图为 ,第一电离能:镁 (填“大于”或“小于”)铝。
(2)现代飞机为了减轻质量而不减轻外壳承压能力,通常采用复合材料--玻璃纤维增强塑料,其成分之一为环氧树脂,常见的E51型环氧树脂中部分结构如下图所示:
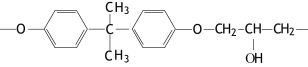

其中碳原子的杂化方式为 ,个数比为 。
II.大型飞机的发动机被誉为航空工业皇冠上的“宝石”。制造过程中通常采用碳化钨做关键部位的材料。
(3)钨元素位于周期表的第六周期第VIB族,请写出其外围电子排布式 ;
(4)下图为碳化钨晶体的一部分结构, 碳原子嵌入金属钨的晶格的间隙,并不破坏原有金属的晶格,形成填隙+固溶体,也称为填隙化合物。在此结构中,其中钨原子有 个,1个钨原子周围距离钨原子最近的碳原子有 个 ,下列金属元素的堆积方式与碳化钨晶胞中碳原子和钨原子所处位置类似的是 。
A. Fe Cu B.Ti Au C.Mg Zn D.Cu Ag
(5)假设该部分晶体的体积为Vcm3,碳化钨的摩尔质量为M g/mol,密度为b g/cm3,则阿伏加德罗常数NA用上述数据可以表示为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤、氢气是常见能源,燃煤烟气中的氮硫氧化物要污染环境,氢气是一种清洁高效的新型能源,如何消除烟气中氮硫氧化物和经济实用的制取氢气成为重要课题。
(1)硫碘循环分解水是一种高效、环保的制氢方法,其流程图如图。
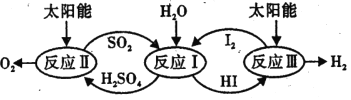
已知:
反应 I:2H2O (1)=2 H2(g) +O2(g) △H1 = +572kJmol-1
反应 II :H2SO4(aq) =SO2 (g) + H2O (l) +![]() O2 ( g) △H2= +327 kJ mol-1
O2 ( g) △H2= +327 kJ mol-1
反应 III:2 HI( aq)=H2 ( g) + I2(g) △H3 =+172k.Jmol-1
则反应SO2 (g)+I2 (g) + 2 H2O (l)=2 HI(aq) + H2SO4 (aq) △H =__________。
(2)用某氢化物 H2 R 高效制取氢气 ,发生的反应为2 H2R(g) ![]() R2(g) +2H2 ( g) 。
R2(g) +2H2 ( g) 。
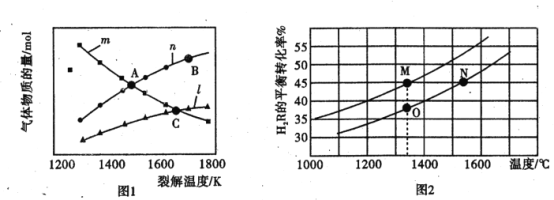
I.若起始时容器中只有H2R, 平衡时三种物质的物质的量与裂解温度的关系如图1。
①图中曲线n 表示的物质是__________(填化学式)。
②C点时,设容器内的总压为p Pa,则平衡常数KP =____________ (用平衡分压代替平衡浓度计算,分压 =总压×物质的量分数)。
II.若在两个等体积的恒容容器中分别加入2.0 mol H 2R、1. 0 molH2R,测得不同温度H2R的平衡转化率如图2 所示。
①M点和O正反应速率v( M) ________v( O) (填“>”“<”或“=”,下同)。
②M 、O 两点容器内的压强P(O)______2 P( M) 。
③平衡常数K( M)_____________K( N)。
(3)以连二硫酸根( S2O42-) 为媒介,使用间接电化学法处理燃煤烟气中的NO, 装置如图所示:
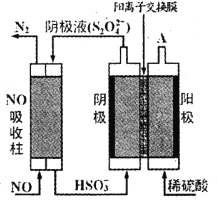
①从 A 口中出来的物质是________________。
②写出电解池阴极的电极反应式________________。
③用离子方程式表示吸收池中除去NO 的原理 ___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
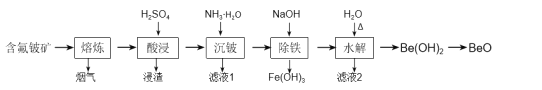
【题目】铍是原子能、火箭、导弹、航空、宇宙航行以及冶金工业中不可缺少的一种新兴材料。以某地的含氟铍矿(主要成分为BeO、CaF2、Al2O3、Fe2O3、SiO2及少量的硫酸盐)为原料,生产工业氧化铍的一种工艺流程如图:
已知:①25℃,Ksp(CaCO3)=8.7×10-9;Ksp(CaSO4)=2.5×10-5;
②Be(OH)2与Al(OH)3性质相似。
回答下列问题:
(1)“熔炼”的温度为1600℃,其中约20%的Al2O3反应生成烟气(主要成分为AlF3),该反应的化学方程式为___。
(2)浸渣的主要成分为CaSO4、___。
(3)加入氨水中和酸浸液,若将pH调至8~9,“沉铍”时产生的沉淀物主要有:___、___、___。
(4)“沉铍”后将滤渣加入足量氢氧化钠溶液提高pH进行“除铁”,铍元素参与反应的离子方程式为___,然后加适量水稀释进行“水解”,目的是___。
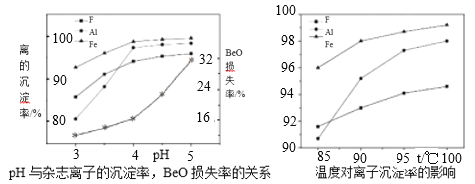
(5)若为高氟铍矿,需在“沉铍”前进行“除氟”。工业上“除氟”是加入10%的氨水,并控制一定的条件,使氟与铝铁形成共沉淀物而除去。根据如图实验数据,选择的实验条件为pH=___,水浴加热温度T=___℃。
(6)氧化铍粗产品含有一定量的硫酸盐会影响铍的后续冶炼,可用碳酸盐脱除,发生反应:CaSO4(s)+Na2CO3(aq)=CaCO3(s)+Na2SO4(aq)。通过计算反应的K值说明用碳酸钠脱硫酸根反应的程度大小:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前20号元素M、N、R、Q、Z的原子序数依次递增,M与Z、N与Q分别同主族,M、N形成的常见化合物有M2N、M2N2,由该5种元素组成的某结晶化合物X常用作净水剂。下列叙述错误的是( )
A.化合物X中含有离子键和共价键
B.简单离子半径由大到小的顺序为ZRQN
C.N、Q分别与Z形成化合物的水溶液均呈碱性
D.R、Q、Z的最高价氧化物的水化物间能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.010mol/L的NaOH溶液滴定10.00mL 0.010mol/L的酸H2A,滴定过程中加入NaOH溶液的体积(V)与溶液中lg![]() 的关系如图所示(10mL之后的曲线未画出)。下列叙述正确的是( )
的关系如图所示(10mL之后的曲线未画出)。下列叙述正确的是( )
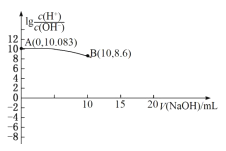
A.H2A![]() H++HA-
H++HA-
B.Ka(HA-)的数量级为10-5
C.滴定过程中,水的电离程度最大的为B点溶液
D.V(NaOH)=15mL时的溶液中:c(Na+)>c(A2-)>c(HA-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气净化器中发生的反应为2NO(g)+2CO(g)![]() N2(g)+2 CO2(g)。一定温度下, 在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
N2(g)+2 CO2(g)。一定温度下, 在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
容器 | 温度/(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | ||||
NO | CO | N2 | CO2 | N2 | CO2 | ||
I | 400 | 0.2 | 0.2 | 0 | 0 | 0.12 | |
II | 400 | 0.4 | 0.4 | 0 | 0 | ||
III | 300 | 0 | 0 | 0.1 | 0.2 | 0.075 | |
下列说法正确是
A. 该反应的ΔS<0、ΔH<0
B. 容器I中达到平衡所需时间2s,则v(N2)=0.06 molL-1·S-1
C. 达到平衡时,体系中c(CO)关系:c(CO,容器II)>2c(CO,容器I)
D. 若起始时向I中充入NO、CO、N2、CO2各0.1mol,开始时V正>V逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。

(1)试剂X的化学式________。A中制取Cl2的离子方程式____________________。
(2)试剂Y的名称为______________。
(3)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中除含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和____________________________;
假设2:存在三种成分:NaHCO3和__________________________。
②设计方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
实验步骤 | 预期现象和结论 |
步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中 | |
步骤2:向A试管中滴加BaCl2溶液 | __________________ |
步骤3:______________ | __________________ |
(4)已知Cl2O与水反应生成次氯酸,则D中Cl2O进入E反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙醇制取乙烯,并验证乙烯的性质。完成下列填空:
(1)实验室制取乙烯的化学方程式为:________________________________________
(2)可用于制取乙烯的发生装置是____________。(选填编号)
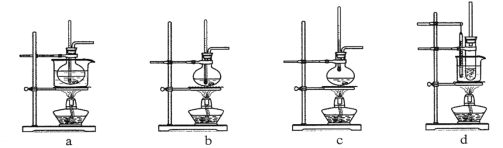
(3)反应液加入碎瓷片的目的是:_______________________。
(4)制得的乙烯中常含有SO2和CO2 ,设计实验证明乙烯能使溴水褪色。(画出装置图)____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com