
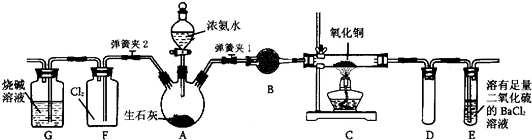
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,加稀硫酸酸化,然后再滴入几滴品红溶液; | 现象:品红不褪色 结论:假设1不成立; |
| 步骤2:另取少量吸收液于试管中, 滴入几滴KSCN溶液. | 现象:溶液变红 结论:假设2成立. |
分析 (1)①根据水的离子积常数Kw=c(H+)•c(OH-)来计算;
②在酸溶液中,氢氧根全部来自于水的电离;
(2)三价铁离子具有氧化性,二氧化硫具有还原性,二者能够发生氧化还原反应生成亚铁离子和硫酸;
(3)①根据反应原理:SO2+2Fe3++2H2O=2Fe2++SO42-+4H+,吸收液中一定存在的离子有H+、Fe2+、SO42-和极少量的OH-外,还可能有的离子:假设1:还存在HSO3-、SO32-;假设2:还存在Fe3+;假设3:HSO3-、SO32-、Fe3+都不存在;
②步骤1:滴入品红溶液,检验溶液中是否有二氧化硫生成;步骤2,利用硫氰化钾溶液检验铁离子,根据结论完成反应现象.
解答 解:(1)①水的离子积常数Kw=c(H+)•c(OH-)=10-a×10-b=10-(a+b)=10-13,
故答案为:10-13;
②100mL 0.1mol/L的稀硫酸溶液中c(H+)=0.2mol/L,在此温度下,水的离子积故Kw=10-13,故c(OH-)=$\frac{K{\;}_{w}}{0.2}$=5×10-13mol/L,而在酸溶液中,氢氧根全部来自于水的电离,故由水电离的c(OH-)=5×10-13mol/L,
故答案为:5×10-13;
(2)铁离子能够氧化二氧化硫,SO2与FeCl3溶液反应的离子方程式为:SO2+2Fe3++2H2O=2Fe2++SO42-+4H+,
故答案为:SO2+2Fe3++2H2O=2Fe2++SO42-+4H+;
(3)①根据反应原理:SO2+2Fe3++2H2O=2Fe2++SO42-+4H+,吸收液中一定存在的离子有H+、Fe2+、SO42-和极少量的OH-外,还可能有的离子:假设1:还存在HSO3-、SO32-;假设2:还存在Fe3+;假设3:HSO3-、SO32-、Fe3+都不存在,
故答案为:HSO3-、SO32-、Fe3+都不存在;
②步骤1,取少量吸收液于试管,滴加稀硫酸酸化,然后再滴入几滴品红溶液,现象是品红没有褪色,证明了假设1是错误的;步骤2,利用硫氰化钾溶液检验溶液中是否含有铁离子,方法是另取少量吸收液于试管中,滴入几滴KSCN溶液,现象为溶液显示红色,说明假设2是正确的,
故答案为:
| 实验步骤 | 现象和结论 |
| 品红不褪色 | |
| 步骤2:另取少量吸收液于试管中,滴入几滴KSCN溶液 | 溶液变红 |
点评 本题属于化学原理和实验探究的综合题,要根据实验原理提出假设,再结合物质的性质加以验证,侧重于考查学生的实验探究能力和对知识的应用能力,注意水的离子积常数的应用,题目难度中等.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
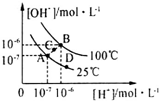
| A. | 图中A、B、D三点处Kw的大小关系:B>A>D | |
| B. | 25℃时,向pH=1的稀硫酸中逐滴加入pH=8的稀氨水,溶液中c(NH4+)/c(NH3•H2O)的值逐渐减小 | |
| C. | 在25℃时,保持温度不变,在水中加人适量NH4Cl固体,体系可从A点变化到C点 | |
| D. | 100℃时,0.05mol•L-1 H2SO4溶液的pH≠1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
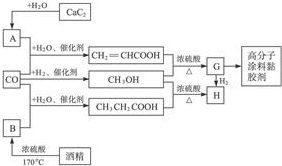
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为53、中子数为78的碘原子:${\;}_{53}^{131}$I | |
| B. | 硫离子的结构示意图: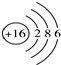 | |
| C. | H2O2的结构式:H-O-H-O | |
| D. | NH4I的电子式: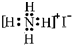 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeO与稀硝酸反应:FeO+2H+═Fe2++H2O | |
| B. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应:Fe2++2OH-═Fe(OH)2↓ | |
| C. | 向碳酸钠溶液中逐滴加入与之等体积等物质的量浓度的稀醋酸:CO32-+H+═HCO3- | |
| D. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
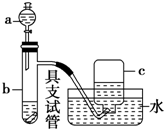 如图是用浓硝酸、铜片、水等试剂探究浓、稀硝酸的强氧化性并观察还原产物的实验装置.
如图是用浓硝酸、铜片、水等试剂探究浓、稀硝酸的强氧化性并观察还原产物的实验装置.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com