
 已知:反应①②③的平衡常数(K)与反应热(△H)的部分相关数据如表所示.
已知:反应①②③的平衡常数(K)与反应热(△H)的部分相关数据如表所示.| 反应 | 平衡常数(K) | 反应热(△H) | |
| 900℃ | 1100℃ | 900℃ | |
| ①Fe(s)+CO2(g) FeO(s)+CO(g) | 1.98 | 2.15 | akJ/mol |
| ②Fe(s)+H2O(g) FeO(s)+H2(g) | 1.98 | 1.47 | |
| ③CO(g)+H2O(g)CO2(g)+H2(g) | ckJ/mol | ||
| △c |
| △t |
 ,故答案为:
,故答案为: .
.| x2 |
| (0.6-x)?(0.3-x) |
| 0.2mol/L |
| 5min |


科目:高中化学 来源: 题型:
| 阳离子 | Na+ Mg2+ Al3+ Ba2+ Fe3+ | ||||
| 阴离子 | OH- Cl- C
|
查看答案和解析>>
科目:高中化学 来源: 题型:
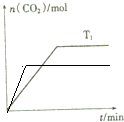
 氮气及含氮的化合物在国民经济中占有重要地位.合成氨工业中,合成塔中每产生2mol NH3,放出92.4kJ热量.
氮气及含氮的化合物在国民经济中占有重要地位.合成氨工业中,合成塔中每产生2mol NH3,放出92.4kJ热量.| n(NH3) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有一种元素组成的物质,一定是纯净物 |
| B、酸性氧化物一定都是非金属氧化物 |
| C、非金属元素组成的化合物一定含有共价键 |
| D、阴阳离子中均分别只含有一种元素,则由这样的阴阳离子组成的物质一定是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 肉桂醛F(化学式为C9H8O )在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的:
肉桂醛F(化学式为C9H8O )在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的:查看答案和解析>>
科目:高中化学 来源: 题型:
 (双烯合成,也可表示为
(双烯合成,也可表示为 )
)

| 2H2 |
| Ni |
| -2H2O |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制FeCl3溶液时,常将FeCl3先溶于盐酸,然后再加水稀释 |
| B、用加热蒸发Na2CO3溶液的方法获得Na2CO3晶体 |
| C、向沸水中滴加FeCl3溶液来制取Fe(OH)3胶体 |
| D、直接加热MgCl2溶液制取无水MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe在氯气中燃烧生成FeCl2 |
| B、SiO2的化学性质不活泼,不与任何酸发生反应 |
| C、常温下,铝制品用浓硫酸或浓硝酸处理过,可耐腐蚀 |
| D、铁粉中混有铝粉既可用过量的NaOH溶液,也可以用过量FeCl3溶液充分反应过滤除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质的量浓度相等的NH4Al(SO4)2、NH4HCO3、NH4Cl溶液中c(NH4+):NH4HCO3>NH4Cl>NH4Al(SO4)2 |
| B、1.0mol?L-1Na2CO3溶液:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| C、测得酸式盐NaHA溶液的PH=3,则NaHA在溶液中一定是电离大于水解 |
| D、某二元弱酸的酸式盐NaHA溶液中:c(Na+)=c(HA-)+c(H2A)+c(A2-)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com