
【题目】羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制得
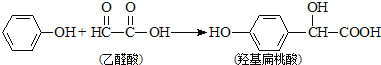
下列有关说法正确的是
A. 苯酚和羟基扁桃酸互为同系物
B. 标准状况下,22.4L羟基扁桃酸中共用电子对的数目为24NA
C. 乙醛酸只存在一种不同环境的氢原子
D. 羟基扁桃酸分子中至少有12个原子共平面
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】向1L含0.01molNaAlO2和0.02molNaOH的溶液中缓慢通入二氧化碳,随n(CO2)增大,先后发生三个不同的反应,当0.01mol<n(CO2) ![]() 0.015mol时发生的反应是:
0.015mol时发生的反应是:
2 NaAlO2+ CO2+2H2O=2Al(OH)3↓+Na2CO3。下列对应关系正确的是
选项 | n(CO2)/mol | 溶液中离子的物质的量浓度 |
A | 0 | c(Na+)>c(AlO2-)+c(OH-) |
B | 0.01 | c(Na+)>c(AlO2-)> c(OH-)>c(CO32-) |
C | 0.015 | c(Na+)> c(HCO3-)>c(CO32-)> c(OH-) |
D | 0.03 | c(Na+)> c(HCO3-)> c(OH-)>c(H+) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与应用的说法中,均正确的是
A.石英能导电,所以用作光导纤维
B.明矾与水反应生成氢氧化铝胶体,可用于自来水消毒
C.氧化铝熔点高,常用于耐高温材料
D.苏打溶液呈弱碱性,可用作胃酸中和剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
酯中的OR′被一个醇(或酚)的OR″置换的反应称为酯交换反应(ester exchange)。
RCOOR′+R″OH![]() RCOOR″+R′OH
RCOOR″+R′OH
该反应在生物柴油、高分子材料合成等方面具有重要价值。下面是以乙烯为原料,利用酯交换反应合成高分子材料PC和PET的一种合成路线(部分产物及反应条件已略去):
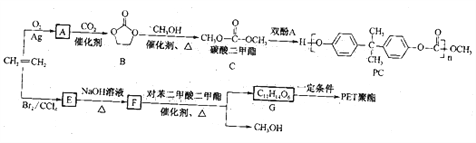
回答下列问题:
(1)A是一种三元环状化合物,且由乙烯生成A时反应的原子利用率为100%,则A的结构简式为_____________。
(2)“双酚A”的结构简式为__________,高分子材料PC中所含官能团的名称是__________。
(3)由B→C的反应类型是_____________,由G→PET聚酯的反应类型是_____________。
(4)由E→F得化学方程式为_______________________________________________。
(5)满足如下条件的对苯二甲酸二甲酯的同分异构体共有_____________种,其中核磁共振氢谱有4组峰,且峰面积之比为1∶1∶1∶2的同分异构体的名称为_____________。
①苯环上的一氯代物只有两种
②苯环上的取代基不超过三个
③0.1mol该有机物与足量的碳酸氢钠溶液反应,能产生4.48L(标准状况下)CO2
(6)参照![]() 的合成方法,设计一条由2-溴丙烷和必要的无机试剂制备
的合成方法,设计一条由2-溴丙烷和必要的无机试剂制备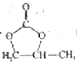 的合成路线:_________________________。
的合成路线:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸是一种重要的有机酸,在工业合成和医学上有重要的用途。
回答下列问题:
(1)乙酸俗称______________。
(2)CH3COOH(I)、C(s)、H2(g)的燃烧热△H分别为-870.3kJ·mol-1、-393.5 kJ·mol-1、-285.8 kJ·mol-1,则反应2C(s)+2H2(g)+O2(g)=CH2COOH(I)的△H=______________。
(3)乙酸和乙酸钠按一定比例混合可制成治疗酸中毒或碱中毒的缓冲溶液。
①用离子方程表示该缓冲溶液能治疗碱中毒的原因:____________________________。
②常温下,体积为1L,浓度为0.1mol·L-1的乙酸电离度为1.3%,该温度下乙酸的电离平衡参数值为__________________(水的电离忽略不计,结果保留两位有效数字);向该溶液中加入_______molCH3COONa可使溶液的pH约为4(溶液体积变化忽略不计)。
(4)已知乙酸蒸气中存在乙酸二聚物,二者如下平衡:(CH3COOH)2(g)![]() 2CH3COOH(g) △H。
2CH3COOH(g) △H。
实验测定该平衡体系的![]() 随温度和压强的变化如图所示:
随温度和压强的变化如图所示:

①上述反应的△H_____(填“>”或“<”)0,a、b、c三点中平衡常数最大的点是______。
②测定乙酸的摩尔质量应选择的适宜条件是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,用化学用语回答:
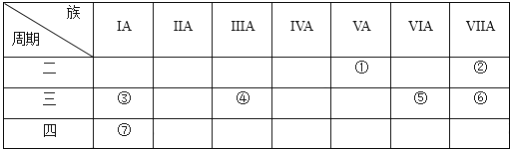
(1)②的元素符号为_________。
(2)比较元素③和⑦的原子半径大小:③_____⑦(填“>”或“<”)。
(3)绘出元素⑤的离子结构示意图_________________。
(4)元素①的氢化物的电子式为____________,将该氢化物通入④和⑥形成的化合物的水溶液中,发生反应的离子方程式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用电解法处理含镍酸性废水并得到单质镍的原理如图所示。下列说法错误的是

已知:①Ni2+在弱酸性溶液中发生水解;
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A. 碳棒上发生的电极反应:4OH4e= O2↑+2H2O
B. 为了提高镍的产率,电解过程中需要控制废水的pH
C. 电解过程中,B中NaCl溶液的物质的量浓度将不断减少
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学依照如下图所示流程提取海带中的碘元素。

(1)步骤①中灼烧海带所用的仪器是__________(填序号)。
a. 试管 b. 坩埚 c. 烧杯
(2)步骤④中用硫酸酸化的H2O2溶液将I-氧化成I2,反应的离子方程式是
______________________________________________________________。
(3)步骤⑤中采用的分离方法是______________________________。
(4)步骤⑤还可以选用的试剂是_______________(填字母序号)。
a. 苯 b. 乙醇 c. 乙酸 d. 己烷
(5)经步骤⑤得到含I2的CCl4溶液后,继续采取步骤⑥⑦的目的是____________________。
(6)步骤⑦的反应中,当1mol IO3- 发生反应时,转移电子的物质的量是__________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com