
| A��100mL pH=3������ʹ�����Һ��������п��Ӧʱ����ʼʱ���߲������������ʴ���� |
| B��100 mL 1 mol��L��1�������50 mL 2 mol��L��1������ֱ���������п��Ӧ�����߷ų����������ʺ���������� |
| C��100 mL pH=3������ʹ�����Һ��������п��Ӧ��������������������� |
| D��100 mL 0.1mol��L��1�������������Һ��������п��Ӧ��ǰ�߷ų������������Ǻ��߷ų�����������2�� |
 һ����������ϵ�д�
һ����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������ʵ��ʱ�����¶�Ϊ22 �� |
| B����ʵ�������ѧ�ܿ���ת��Ϊ���� |
| C��NaOH��Һ��Ũ��Լ��1.5mol/L |
| D����ʵ�������ˮ���ɵķ�Ӧ���Ƿ��ȷ�Ӧ |
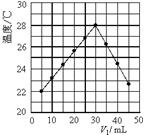
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ʯ�������� | B����̪����ɫ��ȥ |
| C�����ȡ��ɳȱ�� | D�����ȡ��ɻƱ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 OH����H+ ����25�桢35��ʱ�����ӻ��ֱ�ΪK��25�棩=1��10-14 ��K��35�棩=2.1��10-14 ����������������ȷ���ǣ� ��
OH����H+ ����25�桢35��ʱ�����ӻ��ֱ�ΪK��25�棩=1��10-14 ��K��35�棩=2.1��10-14 ����������������ȷ���ǣ� ��| A����35�棬��ˮ��C(H+)��C(OH��) |
| B��ˮ�ĵ���Ȧ���25�棩������35�棩 |
| C��25��ʱ����ˮ�м���������������ƶ���ʹˮ�ĵ���ƽ�������ƶ���ˮ�����ӻ���С |
| D��ij�¶��´�ˮ��C(H+) Ϊ2��10-7 mol/L�����ʱ��C(OH-) ҲΪ2��10-7 mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
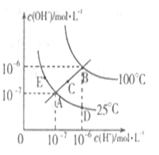
| A��ͼ�����Kw��Ĺ�ϵ��B>C>A=D=E |
| B������A�㵽D�㣬�ɲ�����ˮ�м���������ķ��� |
| C������A�㵽C�㣬�ɲ����¶Ȳ���ʱ��ˮ�м�������NH4C1����ķ��� |
| D��������B��ʱ����pH =2��������Һ��pH = 10��KOH��Һ�������ϣ�������Һ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ߢ٢ۢڢ�ݢܢޢ� | B���ߢ٢ڢۢ�ܢݢޢ� |
| C����ޢݢܢ�ۢڢ٢� | D���٢ߢڢۢ�ܢޢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����25�洿ˮ�м�����H2SO4(�¶Ȳ���),c(H+)��c(OH-)�˻����� |
| B��c(H+)Խ����pHԽ����Һ�ļ���Խǿ |
| C��pH=0����Һ������ֻ����H+������OH- |
| D������Һ��c(OH-)=10-7 mol/L,�����Һһ�������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com