
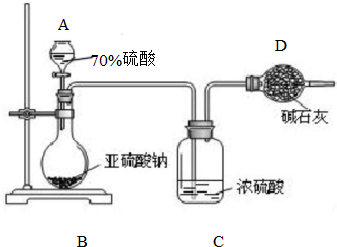
 为测定某亚硫酸钠样品的纯度,甲同学称取10.0g固体,进行如下实验:
为测定某亚硫酸钠样品的纯度,甲同学称取10.0g固体,进行如下实验:| 126×4.8g |
| 64 |
| 9.45g |
| 10.0g |


科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.04 |
| B、0.04mol/(L.s) |
| C、0.08mol(L.s) |
| D、0.04mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、18gH2O含有10 NA个质子 |
| B、1mol己烷含有18NA个化学键 |
| C、22.4L氨水含有NA个NH3分子 |
| D、56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在0.1 mol NaHSO4晶体中阳离子与阴离子总数为0.3 NA |
| B、22.4L NH3中含有的原子总数为4NA |
| C、1mol单质钠在常温下或点燃条件下与O2完全反应转移的电子数都为NA |
| D、常温条件下,等物质的量浓度的HCl溶液和NaOH溶液混合,溶液pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
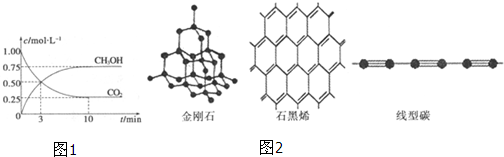
 温室气体二氧化碳减排的一种方法是:从燃煤电厂或天然气电厂排放气中回收CO2,再与CH4热解炉产生的H2厂生成CH3OH:CO2(g)+3H2(g)
温室气体二氧化碳减排的一种方法是:从燃煤电厂或天然气电厂排放气中回收CO2,再与CH4热解炉产生的H2厂生成CH3OH:CO2(g)+3H2(g)
| ||
| A、在前3分钟内v(H2)=10molL-1min-1 |
| B、在3分钟时CO2和CH3OH浓度相等,反应达到平衡 |
| C、在前15分钟内平衡常数K随CO2减少而逐渐减小 |
| D、在前15分钟时向设备中充入CO2和H2各10mol以提高H2转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
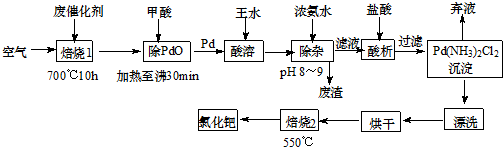
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
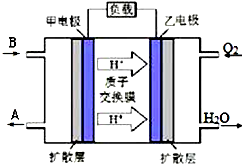 已知A、B、C、D是中学化学常见物质,它们在一定条件下有A+B→C+D的转化关系.
已知A、B、C、D是中学化学常见物质,它们在一定条件下有A+B→C+D的转化关系.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com