
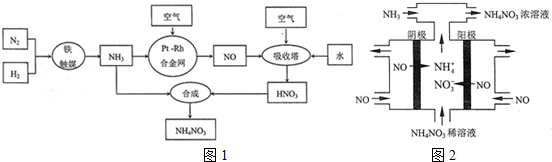
分析 (1)合成氨的工业设备是合成塔;合成氨的反应属于放热反应;合成氨的原料气必须先脱硫,生产中应防止催化剂中毒;
(2)在吸收塔中二氧化氮与水反应生成硝酸和NO,通入空气,NO能被空气中的氧气氧化为二氧化氮,二氧化氮再与水反应生成硝酸,这样使NO循环利用,全部转化为硝酸;
(3)方法一最大的缺点是单独的NO不能被吸收,只能与NO2一起被碱液吸收;方法三和方法二相比,优点是甲烷比氨价格便宜;缺点是方法三的耗能较高;
(4)①工业上电解NO制备 NH4NO3,由装置图可知阳极发生氧化反应,NO被氧化生成NO3-,阴极发生还原反应,NO被还原生成NH4+,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,结合电极方程式解答;
②根据转移的电子守恒解答;
(5)根据氮原子守恒可知,NH3~NO~HNO3,以此计算.
解答 解:(1)合成氨的工业设备是合成塔;合成氨的反应属于放热反应,反应过程中会放出大量的热,用热交换器可以充分利用余热,节约能源;N2与H2合成NH3,生产中原料气必须进行脱硫可以防止催化剂中毒;
故答案为:合成塔;充分利用热能,节约能源;防止催化剂中毒;
(2)在吸收塔中二氧化氮与水反应生成硝酸和NO,通入空气,NO能被空气中的氧气氧化为二氧化氮,二氧化氮再与水反应生成硝酸,这样使NO循环利用,全部转化为硝酸,反应的化学方程式为4NO+3O2+2H2O=4HNO3;
故答案为:4NO+3O2+2H2O=4HNO3;可使NO循环利用,提高原料利用率;
(3)方法一最大的缺点是单独的NO不能被吸收,只能与NO2一起被碱液吸收;方法三和方法二相比,优点是甲烷比氨价格便宜,节约成本;缺点是方法三的反应热为+867kJ•mol-1,耗能较高;
故答案为:单独的NO不能被吸收;耗能高;
(4)①电解NO制备NH4NO3,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总反应方程式为:8NO+7H2O$\frac{\underline{\;电解\;}}{\;}$3NH4NO3+2HNO3,因此补充NH3,使电解产物全部转化为NH4NO3,
故答案为:使电解产物全部转化为NH4NO3;
②维持电流强度为3A,电解2小时,时间为7200S,F=96500C•mol-1,Q=It=3.0C/s×7200S,则理论上可制得NH4NO3的最大质量为$\frac{3.0C/S×7200S}{\frac{96500C/mol}{3}}×80g/mol=6.0g$
故答案为:6.0;
(5)由NH3制NO的产率是94%、NO制HNO3的产率是89%,根据氮原子守恒可知,NH3~NO~HNO3,则1mol氨气可得到硝酸1mol×94%×89%=0.8366mol,由HNO3+NH3═NH4NO3,则该反应消耗的氨气的物质的量为0.8366mol,氨气的质量之比等于物质的量之比,则制HNO3所用去的NH3的质量占总耗NH3质量的百分数为 $\frac{1mol}{1mol+0.8366mol}$×100%=54.4%;即制HNO3所用去的NH3的质量占总耗NH3质量的54.4%,
故答案为:54.4%.
点评 本题考查了工业制备原理应用,流程分析,实验制备物质的分析判断,利用物质的转化及质量守恒的方法来进行计算,明确转化中的化学反应得出物质之间的关系是解答的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | NH5的电子式为: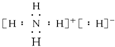 | |
| B. | 分馏、干馏、裂化都是化学变化 | |
| C. | 2-甲基-1-丁烯的结构简式: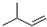 | |
| D. | NaHSO4和Na2O2的阴、阳离子个数比均为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸 | B. | 加入NaOH溶液 | C. | 加入澄清石灰水 | D. | 通入CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
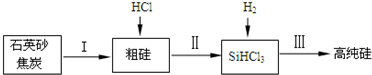
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
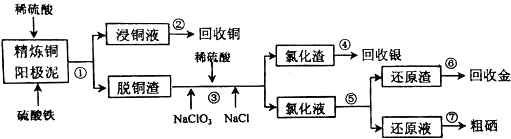
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用液化石油气可以完全杜绝厨房污染 | |
| B. | 为防止流感传染,可将教室门窗关闭后,用食醋熏蒸,进行消毒 | |
| C. | 氯化钠是家庭常用的防腐剂,可用来腌制食品 | |
| D. | 医疗上常用体积分数为70%~75%的酒精作消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合小苏打和烧碱溶液 HCO3-+H+═H2O+CO2↑ | |
| B. | 氯化铝溶液中加入氨水Al3++3OH-═Al(OH)3↓ | |
| C. | 加热碳酸氢钙溶液 Ca2++2HCO3-═CaCO3↓+H2O+CO2↑ | |
| D. | 氢氧化镁中加入稀硫酸H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
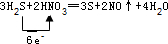 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com