
【题目】某化学实验小组欲制备三草酸合铁(Ⅲ)酸钾并用离子交换法测定其配离子的电荷,实验过程如下:
Ⅰ.三草酸合铁(Ⅲ)酸钾的制备
①称取![]() ,加数滴
,加数滴![]() ,另称取
,另称取![]() ,分别以蒸馏水溶解,将两溶液缓慢混合并加热至沸,搅拌并维持微沸约
,分别以蒸馏水溶解,将两溶液缓慢混合并加热至沸,搅拌并维持微沸约![]() 后停止加热,此时有
后停止加热,此时有![]() 晶体产生,待充分沉降后过滤,以热蒸馏水洗涤沉淀。
晶体产生,待充分沉降后过滤,以热蒸馏水洗涤沉淀。
②称取![]() ,加
,加![]() 蒸馏水,微热使其溶解,将该溶液加至已洗净的
蒸馏水,微热使其溶解,将该溶液加至已洗净的![]() 中,将盛该混合物的容器置于40℃热水中,以滴管缓慢加入约
中,将盛该混合物的容器置于40℃热水中,以滴管缓慢加入约![]() ,边加边搅拌,加完后,需检验
,边加边搅拌,加完后,需检验![]() 是否氧化彻底。
是否氧化彻底。
③在生成![]() 的同时也有
的同时也有![]() 生成,需在微沸情况下补加
生成,需在微沸情况下补加![]() 溶液,将其进一步转化为
溶液,将其进一步转化为![]() 。向所得绿色溶液中加入
。向所得绿色溶液中加入![]() 乙醇,将一小段棉线悬挂在溶液中,一端固定好,盖好烧杯,暗处放置数小时,即有
乙醇,将一小段棉线悬挂在溶液中,一端固定好,盖好烧杯,暗处放置数小时,即有![]() 析出,抽滤,向晶体上滴加少许乙醇,继续抽干,转移至表面皿上,低温干燥
析出,抽滤,向晶体上滴加少许乙醇,继续抽干,转移至表面皿上,低温干燥![]() ,称重,计算产率。
,称重,计算产率。
回答下列问题:
(1)步骤①中加硫酸的作用是___________,如何证明沉淀已洗净________________________。
(2)步骤②中,检验![]() 所用的试剂是______________,不能用酸性
所用的试剂是______________,不能用酸性![]() 溶液检验的理由是_____________________。
溶液检验的理由是_____________________。
(3)写出步骤③中![]() 转化为
转化为![]() 的化学反应方程式_____________。
的化学反应方程式_____________。
Ⅱ.离子交换法测定三草酸合铁(Ⅲ)酸钾中配离子的电荷
原理:利用离子交换树脂对某些离子具有特别的亲和力,当含有这些离子的溶液流过交换树脂时,会吸附在树脂上,树脂上原有的另一类同种电性离子会被溶液带出,从而实现离子的完全交换。
实验步骤:将准确质量的样品溶于水后,使其完全通过![]() 型离子交换树脂,样品中配离子即与氯离子实现交换。
型离子交换树脂,样品中配离子即与氯离子实现交换。
(4)若流出的交换液中![]() ,被交换配离子n(配离子)
,被交换配离子n(配离子)![]() ,则该配离子的负电荷数为___________________。
,则该配离子的负电荷数为___________________。
(5)以沉淀滴定法测定![]() :将流出液稀释至
:将流出液稀释至![]() ,取
,取![]() ,以
,以![]() 为指示剂,用
为指示剂,用![]() 标准溶液滴定至终点,消耗标准溶液
标准溶液滴定至终点,消耗标准溶液![]() 。
。
①溶解度![]() ________
________![]() (填“大于”或“小于”)。
(填“大于”或“小于”)。
②若离子交换步骤称取的样品物质的量为![]() ,该样品中配离子所带的负电荷数为______________。
,该样品中配离子所带的负电荷数为______________。
【答案】抑制![]() 水解 取最后一次的洗涤液加入氯化钡溶液,若不产生沉淀则已洗净(其他合理答案)
水解 取最后一次的洗涤液加入氯化钡溶液,若不产生沉淀则已洗净(其他合理答案) ![]() 溶液中的
溶液中的![]() 也可与
也可与![]() 反应,干扰检验
反应,干扰检验 ![]() (反应条件答“微沸“也可)
(反应条件答“微沸“也可) ![]() 大于 2.8
大于 2.8
【解析】
Ⅰ.根据制备流程,结合盐类的水解、混合物的分离提纯操作分析解题即可。
Ⅱ.根据溶液是电中性和电荷守恒分析离子交换法测定三草酸合铁(Ⅲ)酸钾中配离子的电荷。
(1)Fe2+易水解,则步骤①中(NH4)2Fe(SO4)2固体中先加硫酸的作用是抑制Fe2+水解;沉淀表面附着液中含有SO42-,则取最后一次的洗涤液加入氯化钡溶液,若不产生沉淀则沉淀已洗净;
(2)步骤②中,因溶液中的![]() 有还原性,也可与
有还原性,也可与![]() 反应,干扰检验,故检验
反应,干扰检验,故检验![]() 应选择
应选择![]() ,而不能用酸性
,而不能用酸性![]() 溶液;
溶液;
(3)步骤③中![]() 转化为
转化为![]() 的化学反应方程式为
的化学反应方程式为![]() ;
;
(4)溶液是电中性的,则Cl-所带负电荷总量和被交换配离子所带负电荷总量相等,即xmol×1=ymol×n,n=![]() ,即该配离子的负电荷数为
,即该配离子的负电荷数为![]() ;
;
(5)①选用K2CrO4溶液作指示剂,说明Cl-沉淀完全后才生成Ag2CrO4,可知Ag2CrO4溶解度大于AgCl;
②滴定时消耗21.00mL0.100mol/LAgNO3溶液,则溶液中Cl-的物质的量为0.100mol/L×0.021L×![]() =0.0084mol,结合电荷守恒可知样品中配离子所带的负电荷数为
=0.0084mol,结合电荷守恒可知样品中配离子所带的负电荷数为![]() =2.8。
=2.8。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】红矾钠(重铬酸钠:![]() )是重要的基本化工原料,应用十分广泛。工业制备红矾钠的流程如下:
)是重要的基本化工原料,应用十分广泛。工业制备红矾钠的流程如下:
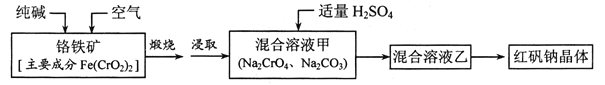
请回答下列问题:
(1)![]() 的基态电子排布式为____________。
的基态电子排布式为____________。
(2)锻烧铬铁矿发生反应:____________Fe(CrO2)2+Na2CO3+O2![]() Fe2O3+Na2CrO4+CO2 配平上述化学反应方程式。
Fe2O3+Na2CrO4+CO2 配平上述化学反应方程式。
(3)溶液甲中加入H2SO4时,可以观察到溶液由黄色变为橙色,并放出无色气体,有关反应的离子方程式为____________。
(4)制备红矾钠的废水必须进行处理。首先酸化废水,将含+6价铬的酸性废液放入电解槽内,用铁作阳极进行电解,阴极析出H2,阳极产物被![]() 氧化然后转化为Cr(OH)3、 Fe(0H)3 沉淀。
氧化然后转化为Cr(OH)3、 Fe(0H)3 沉淀。
①阳极的电极反应式为(不考虑后续反应):____________。
②溶液中金属离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因:______。
③已知某含![]() 的酸性废水中Cr元素的含量是52.5mg/L,处理后Cr元素最高允许 排量为0.5 mg/L。要处理100 m3废水达到排放标准,至少消耗铁_____kg。
的酸性废水中Cr元素的含量是52.5mg/L,处理后Cr元素最高允许 排量为0.5 mg/L。要处理100 m3废水达到排放标准,至少消耗铁_____kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要95 mL l.0 mol/L稀硫酸,现用98%的浓硫酸(其密度为1.84 g.mL-l)来配制。
(1)实验需要的玻璃仪器有50 mL烧杯、玻璃棒、胶头滴管、____、____。
(2)玻璃棒的作用为____,胶头滴管的作用为________,
(3)配制过程中,下列情况会使配制结果偏低的是(填序号)____。
A.将稀释的硫酸液转移至容量瓶后,洗涤烧杯和玻璃棒2-3次。
B.将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外。
C.容量瓶使用时未干燥。
D.用胶头滴管加水时,仰视观察溶液凹液面与容量瓶刻度相切。
E.未冷却至室温就定容。
F.定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁是现代钢铁生产的重要环节,此法工艺简单,产量大,能耗低,仍是现代炼铁的主要方法,回答下列问题:
(1)已知炼铁过程的主要反应为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H1
还会发生3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2=a kJ/mol;
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H3=b kJ/mol;
FeO(s)+CO(g)=Fe(s)+ CO2(g) △H4=c kJ/mol;
则△H1=________kJ/mol(用含a、b、c的代数式表示)。
(2)高炉炼铁产生的废气(CO、CO2)有多种处理方法,反应原理如下:
①生成甲醇:CO(g)+2H2(g)![]() CH3OH(l)。一定温度下在恒容密闭容器中模拟此反应,下列化学反应速率最快的是_______________
CH3OH(l)。一定温度下在恒容密闭容器中模拟此反应,下列化学反应速率最快的是_______________
A.υ(CO)=1.2 mol/(L·min) B.υ(H2)=0.025 mol/(L·s) C.υ(CH3OH)=1 mol/(L·min)
②生成乙烯:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)。在两个容积相同的密闭容器中以不同的氢碳比[n(H2):n(CO2)]充入原料气,CO2平衡转化率α(CO2)与温度的关系如图所示
C2H4(g)+4H2O(g)。在两个容积相同的密闭容器中以不同的氢碳比[n(H2):n(CO2)]充入原料气,CO2平衡转化率α(CO2)与温度的关系如图所示
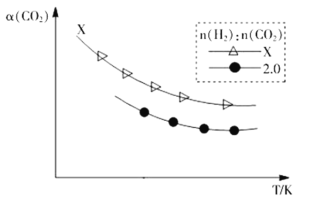
氢碳比X_____2.0(填>、<或=,下同),理由是___________________。
(3)反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),其化学平衡常数K与温度T关系如表:
CH3OH(g)+H2O(g),其化学平衡常数K与温度T关系如表:
T/℃ | 700 | 800 | 1000 | 1200 |
K | 0.6 | 1.0 | 2.3 | 3.6 |
①该反应是___________反应(填“吸热”或“放热”)。
②若某恒定温度下,向容积为1 L的恒容密闭容器中充入2 mol CO2、3 mol H2,10 min后反应达到平衡状态,测得υ (CH3OH)=0.075 mol/(L·min),则此反应条件下温度______800℃(填>、<或=)。
③若反应在1200℃进行试验,某时刻测得反应容器中各物质浓度满足关系式2c(CO2)·c3(H2)=3c(CH3OH)·c(H2O),此时反应在________向进行(填“正”或“逆”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物二苯基乙二酮常用作医药中间体及紫外线固化剂,可由二苯基羟乙酮氧化制得,反应的化学方程式及装置图(部分连接装置省略)如图:
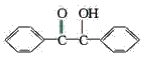 +2FeCl3
+2FeCl3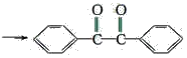 +2FeCl2+2HCl
+2FeCl2+2HCl
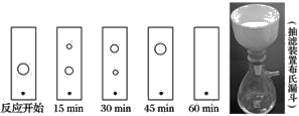
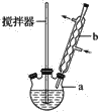
装置图中的两种玻璃仪器a为三颈烧瓶、b为球形冷凝管(或冷凝管),在反应装置中,加入原料及溶剂,搅拌下加热回流。反应结束后加热煮沸,冷却后即有二苯基乙二酮粗产品析出,用70%乙醇水溶液重结晶提纯。
重结晶过程:加热溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥
根据以上信息请回答下列问题:
(1)趁热过滤后,滤液冷却结晶。一般情况下,下列哪些因素有利于得到较大的晶体___。
A.缓慢冷却溶液
B.溶液浓度较高
C.溶质溶解度较小
D.缓慢蒸发溶剂
如果溶液中发生过饱和现象,可采用____等方法促进晶体析出。
(2)试推测抽滤所用的滤纸应略___(填“大于”或“小于”)布氏漏斗内径,将全部小孔盖住。烧杯中的二苯基乙二酮晶体转入布氏漏斗时,杯壁上往往还粘有少量晶体,需选用液体将杯壁上的晶体冲洗下来后转入布氏漏斗,下列液体最合适的是__。
A.无水乙醇
B.饱和NaCl溶液
C.70%乙醇水溶液
D.滤液
(3)上述重结晶过程中的哪一步操作除去了不溶性杂质___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g) ![]() 2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示,已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是( )
2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示,已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是( )
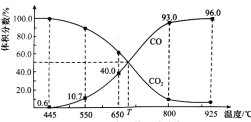
A. 550℃时,若充入惰性气体,v正,v逆均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为25.0%
C. T℃时,若充入等体积的CO2和CO,平衡不移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0p总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.72g金属钠、氧化钠和过氧化钠的混合物与足量水反应,在标准状况下得到672mL混合气体,将混合气体电火花点燃,恰好完全反应,则原混合物中钠、氧化钠、过氧化钠的物质的量之比为( )
A. 3:2:1 B. 4:2:1 C. 2:1:1 D. 1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若含有1 mol铁离子和1 mol铝离子的混合溶液,现按下图横坐标依次加入8 mol 氢氧化钠溶液、1 mol盐酸,通入1 mol 二氧化碳气体,纵坐标为混合沉淀的物质的量。

(1)请画出沉淀的量随反应的变化曲线______________。
(2)并写出加入氢氧化钠6 mol及其后发生的各步反应的离子方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀土铈(Ce)元素主要存在于独居石中,金属铈化学性质十分活泼。近年来发现用铈(Ce)的氧化物可高效制取H2,制备原理如图所示,已知0<![]() <2,下列说法不正确的是
<2,下列说法不正确的是

A.CeO2是水分解的催化剂
B.T<1050℃时,CeO2比CeO2—δ稳定
C.工业上可用电解CeCl4溶液制备Ce
D.过程②的方程式为CeO 2—δ+δH2O![]() CeO2+δH2
CeO2+δH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com