
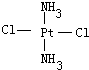 ,黄绿色固体:
,黄绿色固体: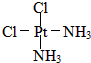 ;
;分析 (1)根据Pt(NH3)2Cl2可以形成两种固体知:Pt(NH3)2Cl2具有平面四边形结构,Pt处在四边形中心,NH3和Cl分别处在四边形的4个角上;
(2)Pt(NH3)2Cl2分子是平面结构,两个Cl原子有相邻或相对两种位置;
(3)根据“相似相溶原理”解答:水分子为极性分子,题中两种固体一种为淡黄色,在水中的溶解度小,应为非极性分子组成的物质,另一种为黄绿色,在水中的溶解度较大应为极性分子组成的物质;
(4)水为极性分子构成的溶剂,黄绿色固体为极性分子构成的溶质,据“相似相溶原理”故黄绿色固体在水中溶解度比淡黄色固体大.
解答 解:(1)Pt(NH3)2Cl2可以形成两种固体,说明Pt(NH3)2Cl2分子是平面四边形结构,若为四面体结构则只有一种固体形式,故答案为:平面四边形;
(2)Pt(NH3)2Cl2分子是平面结构,两个Cl原子有相邻和相对两种位置,水是极性分子,一种为淡黄色,在水中的溶解度小,则为非极性分子,NH3和Cl分别对称分布在四边形的4个角上,正负电荷重心重合,故淡黄色为: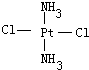 ,另一种为黄绿色,在水中的溶解度较大,则为极性分子,NH3和Cl在四边形的4个角上的分布是不对称的,即正负电荷重心不重合,故黄绿色者是
,另一种为黄绿色,在水中的溶解度较大,则为极性分子,NH3和Cl在四边形的4个角上的分布是不对称的,即正负电荷重心不重合,故黄绿色者是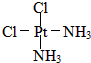 ,故答案为:
,故答案为: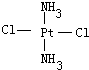 ;
;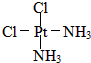 ;
;
(3)水是极性分子,一种为淡黄色,在水中的溶解度小,根据“相似相溶原理”则为非极性分子,另一种为黄绿色,在水中的溶解度较大,根据“相似相溶原理”则为极性分子,故答案为:非极性;极性;
(4)水是极性分子,黄绿色为极性分子,淡黄色固体为非极性分子,根据相似相溶原理可知,淡黄色固体为非极性分子,较难溶于极性溶剂水,而黄绿色固体为极性分子,易溶于极性溶剂水,故答案为:水分子是极性分子,而黄绿色结构的分子也是极性分子,根据相似相溶原理可知黄绿色结构固体在水中的溶解度应比淡黄色固体要大.
点评 本题主要考查了配合物结构与性质关系,题目难度中等,试题综合性较强,解答这类题目要求考生审清题目信息,并与所学知识结合起来解答,注意相似相溶原理的应用.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:选择题
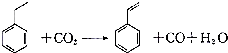
| A. | 分子中含有5个碳碳双键 | B. | 属于不含极性键的共价化合物 | ||
| C. | 分子式为C8H10 | D. | 通过加聚反应生成聚苯乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
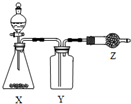 如图是用于制取、收集并吸收多余气体的装置,如表方案正确的是( )
如图是用于制取、收集并吸收多余气体的装置,如表方案正确的是( )| 选项 | X | Y | Z |
| A | 食盐、浓硫酸 | HCl | 碱石灰 |
| B | CaO、浓氨水 | NH3 | 无水CaCl2 |
| C | Cu、浓硝酸 | NO2 | 碱石灰 |
| D | 电石、食盐水 | C2H2 | 含溴水的棉花 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度,将2molCO与5molH2的混合气体充入容积为2L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g)?CH3OH(g).经过5min后,反应达到平衡,此时转移电子6mol.
某温度,将2molCO与5molH2的混合气体充入容积为2L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g)?CH3OH(g).经过5min后,反应达到平衡,此时转移电子6mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
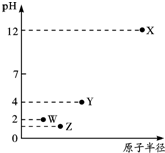
| A. | 简单离子半径:X>Y>Z>W | |
| B. | Y元素存在同素异形体 | |
| C. | 气态氢化物的稳定性:Z>W>Y | |
| D. | X和Y的最高价氧化物对应的水化物恰好中和时,溶液呈中性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com