
分析 得电子的反应物是氧化剂,氧化剂在反应中发生还原反应,失电子的反应物是还原剂,还原剂对应的产物是氧化产物,在数值上,平均式量=平均摩尔质量=$\frac{m(总)}{n(总)}$,据此分析.
解答 解:①8HClO3=3O2↑+2Cl2↑+4HClO4+2H2O中,氧化剂和还原剂都是HClO3,HClO3中Cl元素得电子化合价降低生成Cl2而发生还原反应,所以发生还原反应的过程是HClO3→Cl2;
故答案为:HClO3;Cl2;
②O氧元素的化合价由-2价→0价,Cl元素的化合价由+5价→+7价,所以氧化产物是O2、HClO4;
平均式量=平均摩尔质量=$\frac{3×32+2×71}{5}$=47.6,
故答案为:O2、HClO4,47.6.
点评 本题考查了氧化还原反应,侧重于氧化还原反应基本概念的考查,准确判断氧化还原反应中元素化合价变化是解题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
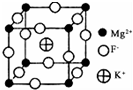 卤族元素是典型的非金属元素,单质及其化合物在工农业生产和生活中有重要的用途.
卤族元素是典型的非金属元素,单质及其化合物在工农业生产和生活中有重要的用途. 查看答案和解析>>
科目:高中化学 来源: 题型:实验题
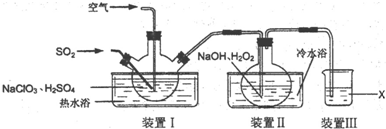
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水:Al3++4NH•H2O═AlO2-+4NH4++2H2O | |
| B. | 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3+3H+ | |
| C. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10℃时0.1 mol/L Na2S2O3和0.1 mol/L H2SO4各 5 mL | |
| B. | 20℃时0.1 mol/L Na2S2O3和0.1 mol/L H2SO4各 5 mL | |
| C. | 10℃时0.1 mol/L Na2S2O3和0.1 mol/L H2SO4各5 mL,加水10mL | |
| D. | 20℃时0.2mol/L Na2S2O3和0.1 mol/LH2SO4各5 mL,加水10 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 置换反应不一定全部是氧化还原反应 | |
| B. | 氧化还原反应中氧化剂和还原剂可以是同种物质 | |
| C. | 氧化反应和还原反应不一定同时发生 | |
| D. | 还原剂是得电子,氧化剂失电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对甲苯酚和苯甲醇 | B. | 甲酸甲酯和甲醛 | ||
| C. | 苯和乙烯 | D. | CH3CH2OH和CH3CH2CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
| A | 盐酸 | 水煤气 | 硫酸 | 干冰 |
| B | 蒸馏水 | 蔗糖溶液 | 氧化铝 | 二氧化硫 |
| C | 胆矾 | 氢氧化铁胶体 | 铁 | 碳酸钙 |
| D | 水银 | 澄清石灰水 | 氯化铜 | 碳酸钠 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com