
| A. | ①②③ | B. | ②④ | C. | ②③④ | D. | ①②④ |
分析 ①甲烷燃烧生成液体水放热大于甲烷反应生成气体水;
②反应热与化学计量数成正比;
③恒容容器中反应进行过程中压强减小,恒压容器中反应过程中压强比恒容容器中大反应物转化率大;
④碳酸钙吸热,氧化钙和水反应放热,据此结合放热反应的焓变小于0分析.
解答 解:①液态水具有能量小于气态水,甲烷燃烧生成液体水放热大于甲烷反应生成气体水,焓变为负值,放热越大,焓变值越小,则△H1<△H2,故①正确;
②氢气和氧气反应时,相同条件下生成水的物质的量越大,放热越大,焓变为负值,则△H1<△H2,故②正确;
③恒容容器中反应进行过程中压强减小,恒压容器中反应过程中压强比恒容容器中大反应物转化率大,则恒压时放热较大,结合焓变为负值可知:△H1<△H2,故③正确;
④碳酸钙吸热,氧化钙和水反应放热,放热反应焓变为负,则△H1>△H2,故④错误;
故选A.
点评 本题考查了反应热大小比较,题目难度中等,明确物质聚聚状态与具有能量的关系为解答关键,注意放热反应的焓变为负值,放出热量越大,焓变值越小,为易错点.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
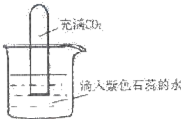 如图将充满CO2的试管倒扣在滴有紫色石蕊的蒸馏水中,一段时间后,下列实验现象描述正确的是( )
如图将充满CO2的试管倒扣在滴有紫色石蕊的蒸馏水中,一段时间后,下列实验现象描述正确的是( )| A. | ①② | B. | ①④ | C. | ②③ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 据反应3NO2+H2O═2HNO3+NO可知,NO2是HNO3的酸酐 | |
| B. | 据反应2NO2(g)?N2O4(g)△<0可知要制得较纯净的NO2,需高温、低压环境 | |
| C. | 据反应Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O和3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,可知浓HNO3的氧化性不如稀HNO3强 | |
| D. | NO2、Br2(g)同为红棕色气体,可用湿润的淀粉-KI试纸鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LNa2S液中:c(OH-)-c(HS-)-c(H+)=2c(H2S) | |
| B. | 0.2mol/L的NH3•H2O溶液和0.1mol/LHCl溶液等体积混合(pH>7):c(NH4+)+c(H+)>c(NH3•H2O)+c(OH-) | |
| C. | 0.1mol/L pH=7.8的NH4HCO3溶液中:c(HCO3-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | 0.1mol/L Na2SO3溶液与0.1mol/L NaHSO3溶液等体积混合:2c(Na+)-3c(SO32-)=3c(HSO3-)+3c(H2SO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com