
| A. | 金属甲的阳离子比同价态的金属乙的阳离子氧化性强,则金属甲比金属乙活泼 | |
| B. | 原电池中电子从负极经过溶液流向正极 | |
| C. | 电解池中电解质溶液的阳离子向阴极迁移 | |
| D. | 在铁制品上镀银,铁做正极,银做负极 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
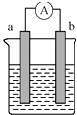 如图是某化学兴趣小组探究不同条件下化学能转化为电能的装置.请回答下列问题.
如图是某化学兴趣小组探究不同条件下化学能转化为电能的装置.请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示,将锌、铜通过导线相连,置于稀硫酸中.
如图所示,将锌、铜通过导线相连,置于稀硫酸中.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8mol | B. | 4mol | C. | 2mol | D. | 6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 装置①依据两容器内气体颜色变化,判断反应2NO2(g)?N2O4(g)平衡移动的方向 | |
| B. | 装置②依据反应后U管两边液面的高低,判断Na和水反应的热效应 | |
| C. | 装置③测定稀强酸与稀强碱反应的中和热 | |
| D. | 装置④用标准的盐酸溶液滴定待测的氢氧化钠溶液(部分加持仪器略去) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com