
【题目】氮氧化物和碳氧化合物的综合治理是当前的重要课题之一。
已知:ⅰ.NO(g)+CO2(g)![]() NO2(g)+CO(g) △H1=+234kJ·mol-1
NO2(g)+CO(g) △H1=+234kJ·mol-1
ⅱ.2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H2=-745kJ·mol-1
N2(g)+2CO2(g) △H2=-745kJ·mol-1
(1)NO2(g)与CO(g)反应生成两种无毒气体的热化学方程式为______________。
(2)反应ⅰ的正反应的活化能E_____△H1(填“>”、“<”或“=”)。
(3)一定压强下,密闭容器中发生反应ⅰ和反应ⅱ。达到平衡后,保持其他条件不变,升高温度,CO(g)的体积分数________(填“增大”、“减少”或“无法确定”),原因为_____________________。
(4)向起始温度为t℃、容积为10L的恒容绝热的密闭容器中充入2molNO(g)和1molCO2(g),发生反应ⅰ。5min时达到平衡。则:
①下列事实能说明该反应达到平衡状态的是________(填选项字母)
A.混合气体温度不变 B.混合气体的压强不变
C. NO2和CO的浓度之比为1: 1 D.混合气体的平均相对分子质量不变
②t℃时,向另一容积为10 L的恒温恒容的密闭容器中充入2 mol NO(g)和1 mol CO2(g),发生反应i。达到平衡的时间______5 min(填“>”、“<”或“=”)。
(5)在某密闭容器中充有10 mol CO(g)和20 mol NO(g),发生反应ii,CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。
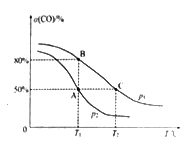
①A、B、C 三点的平衡常数KA、KB、KC的大小关系为________;p1和p2的大小关系为__________。
②A点时.测得容器的体积为10 L,则T1℃时,该反应平衡常数K的值为____________。
【答案】 2NO2(g)+4CO(g)![]() N2(g)+4CO2(g) ΔH=-1213 kJ·mol-1 > 增大 升高温度,反应i的平衡正向移动,反应ii的平衡逆向移动,均使CO体积分数增大 A B < KA=KB>KC p2> p1 1/9
N2(g)+4CO2(g) ΔH=-1213 kJ·mol-1 > 增大 升高温度,反应i的平衡正向移动,反应ii的平衡逆向移动,均使CO体积分数增大 A B < KA=KB>KC p2> p1 1/9
【解析】(1)已知:ⅰ.NO(g)+CO2(g)![]() NO2(g)+CO(g) △H1=+234kJ·mol-1
NO2(g)+CO(g) △H1=+234kJ·mol-1
ⅱ.2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H2=-745kJ·mol-1
N2(g)+2CO2(g) △H2=-745kJ·mol-1
根据盖斯定律可知ⅱ-ⅰ×2即得到NO2(g)与CO(g)反应生成两种无毒气体的热化学方程式为2NO2(g)+4CO(g)![]() N2(g)+4CO2(g) ΔH=-1213 kJ·mol-1。
N2(g)+4CO2(g) ΔH=-1213 kJ·mol-1。
(2)反应ⅰ是吸热反应,反应物总能量小于生成物总能量,因此正反应的活化能E>△H1。(3)反应分别是吸热反应和放热反应,升高温度,反应i的平衡正向移动,反应ii的平衡逆向移动,均使CO体积分数增大。(4)①A.由于是绝热恒容,因此混合气体温度不变时反应达到平衡状态,A正确;B.反应前后体积不变,但温度变化,因此混合气体的压强不变时反应达到平衡状态,B正确;C. NO2和CO均是生成物,二者的浓度之比始终为1: 1,不能据此说明达到平衡状态,C错误;D.反应前后容积和气体的质量均不变,则混合气体的平均相对分子质量始终不变,不能据此说明达到平衡状态,D错误,答案选AB。②由于正反应吸热,如果保持温恒容发生反应i,则反应过程中温度高于保持绝热恒容的容器,温度高反应速率快,所以反应达到平衡的时间<5 min。(5)①平衡常数只与温度有关系,由于正反应放热,升高温度平衡常数减小,则A、B、C 三点的平衡常数KA、KB、KC的大小关系为KA=KB>KC;正反应体积减小,增大压强平衡向正反应方向进行,转化率增大,所以p1>p2。②A点时,测得容器的体积为10 L,转化率是0.5,则根据方程式可知
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始量(mol) 20 10 0 0
转化量(mol) 5 5 2.5 5
平衡量(mol) 15 5 2.5 5
因此T1℃时,该反应平衡常数K的值为![]() 。
。


科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:
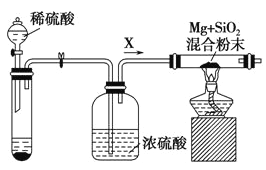
(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:甲、乙、丙、丁为常见化合物,A、B为单质,相互转化关系如图。其中甲是天然气的主要成分。回答下列问题:
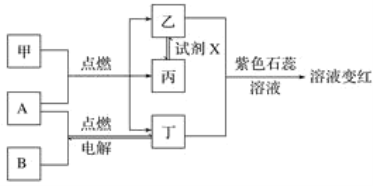
(1)丁物质的名称:______,丙物质的化学式:_________________________________________。
(2)检验化合物乙的化学方程式:___________________________________________________。
(3)试剂X可能的化学式:________、________(要求:所选物质类别不同)。
(4)通过分析表明:燃料充分燃烧的条件之一是______________________________。
(5)取变红溶液于试管中加热,观察到的现象有_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着时代的发展,绿色环保理念越来越受到大家的认同,变废为宝是我们每一位公民应该养成的意识。某同学尝试用废旧的铝制易拉罐作为原材料、采用“氢氧化铝法”制取明矾晶体并进行一系列的性质探究。
制取明矾晶体主要涉及到以下四个步骤:
第一步:铝制品的溶解。取一定量铝制品,置于250mL锥形瓶中,加入一定浓度和体积的强碱溶液,水浴加热(约93℃),待反应完全后(不再有氢气生成),趁热减压抽滤,收集滤液于250mL烧杯中;
第二步:氢氧化铝沉淀的生成。将滤液重新置于水浴锅中,用3 mol/L H2SO4调节滤液pH至8~9,得到不溶性白色絮凝状Al(OH)3,减压抽滤得到沉淀;
第三步:硫酸铝溶液的生成。将沉淀转移至250mL烧杯中,边加热边滴入一定浓度和体积的H2SO4溶液;
第四步:硫酸铝钾溶液的形成。待沉淀全部溶解后加入一定量的固体K2SO4,将得到的饱和澄清溶液冷却降温直至晶体全部析出,减压抽滤、洗涤、抽干,获得产品明矾晶体[KAl(SO4)2·12H2O,M=474g/mol]。
回答下列问题:
(1)第一步铝的溶解过程中涉及到的主要反应的离子方程式为__________________________
(2)为了加快铝制品的溶解,应该对铝制品进行怎样的预处理:________________________
(3)第四步操作中,为了保证产品的纯度,同时又减少产品的损失,应选择下列溶液中的___(填选项字母)进行洗涤,实验效果最佳。
A.乙醇 B.饱和K2SO4溶液 C.蒸馏水 D.1:1乙醇水溶液
(4)为了测定所得明矾晶体的纯度,进行如下实验操作:准确称取明矾晶体试样4.0g于烧杯中,加入50mL 1mol/L盐酸进行溶解,将上述溶液转移至100mL容量瓶中,稀释至刻度线,摇匀;移取25.00 mL溶液干250 mL锥形瓶中,加入30 mL 0.10mol/L EDTA-2Na标准溶液,再滴加几滴2D二甲酚橙,此时溶液呈黄色;经过后续一系列操作,最终用0.20 mol/L锌标准溶液滴定至溶液由黄色变为紫红色,达到滴定终点时,共消耗5.00 mL锌标准溶液。滴定原理为H2Y2-+Al3+→AlY-+2H+,H2Y2-(过量)+Zn2+→ZnY2-+2H+(注:H2Y2-表示EDTA-2Na标准溶液离子)。则所得明矾晶体的纯度为_________%。
(5)明矾除了可以用作人们熟悉的净水剂之外,还常用作部分食品的膨松剂,例如油条(饼)的制作过程需要加入一定量的明矾,请简述明矾在面食制作过程作膨松剂的原理:_______
(6)为了探究明矾晶体的结晶水数目及分解产物,在N2气流中进行热分解实验,得到明矾晶体的热分解曲线如图所示(TG%代表的是分解后剩余固体质量占样品原始质量的百分率,失重百分率=![]() ×100%):
×100%):
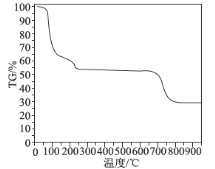
根据TG曲线出现的平台及失重百分率,30~270℃范围内,失重率约为45.57%,680~810℃范围内,失重百分率约为25.31%,总失重率约为70.88%,请分别写出所涉及到30~270℃、680~810℃温度范围内这两个阶段的热分解方程式:___________、_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2 mol A和1 mol B,乙中充入2 mol C和1 mol He,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)![]() 2C(g),反应达到平衡后,恢复到反应发生前时的温度。下列有关说法不正确的是
2C(g),反应达到平衡后,恢复到反应发生前时的温度。下列有关说法不正确的是
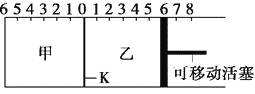
A. 根据隔板K滑动与否可判断左右两边的反应是否达到平衡
B. 达到平衡后,隔板K最终停留在左侧刻度0~2之间
C. 达到平衡时,甲容器中C的物质的量大于乙容器中C的物质的量
D. 若平衡时K停留在左侧1处,则活塞仍停留在右侧6处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结 论 |
A | 将 | 生成了 |
B | 向浓度均为 |
|
C | 淀粉 | 还原性: |
D | 用pH试纸测得: |
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质之间有如下反应关系:
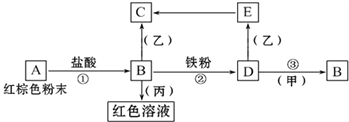
已知由E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色。
回答:
(1) 写出下列物质的化学式:A______B______D________甲_______乙_______丙__________
(2) 写出E→C反应的化学方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2mol·L-1A气体和1mol·L-1B气体混合,并在一定条件下发生反应:2A(g)+B(g)![]() 2C(g),若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法:
2C(g),若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法:
①用物质B表示的反应的平均速率为0.6mol·L-1·s-1
②用物质A表示的反应的平均速率为0.3mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7mol·L-1
其中正确的是( )
A.① ③B.③ ④C.② ③D.② ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是
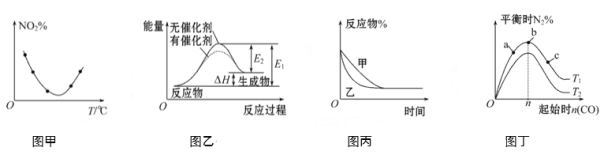
A. 图甲表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)![]() N2O4(g),相同时间后测得NO2含量的曲线,则该反应的ΔH<0
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的ΔH<0
B. 图乙表示的反应是吸热反应,该图表明催化剂不能改变化学反应的焓变
C. 图丙表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(g)的影响,则P乙>P甲
3C(g)+D(g)的影响,则P乙>P甲
D. 图丁表示反应:4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) ΔH<0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,平衡常数K1>K2
N2(g)+4CO2(g) ΔH<0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,平衡常数K1>K2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com