
| A��ԭ�Ӱ뾶��W��Z��Y��X |
| B��YԪ�������ڱ��е�λ��Ϊ�������ڵڢ�A�� |
| C��1 mol��������������ȫ��Ӧ��ת����1 mol���� |
| D��1.0 L 0.1 mol?L-1����Һ���������ܵ����ʵ���С��0.1 mol |


 Сѧ��10���ӿ������100��ϵ�д�
Сѧ��10���ӿ������100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ֻ�����ᷴӦ |
| B��ҽ���Ͽ���������θ����� |
| C�����������ᷴӦʱ�ų���CO2�����������Na2CO3Ҫ�� |
| D��ͬ�¶�ʱ��NaHCO3���ܽ�ȣ�Na2CO3�ܽ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| X | Y |
| W | Z |
| A����Z�ĺ˵������Y����������XΪ̼Ԫ�� |
| B����W�ĺ˵������Y����������X�ǵ�Ԫ�� |
| C��ԭ�Ӱ뾶��Z��Y��X |
| D������⻯����ȶ��ԣ�Y��X��W |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ѡ�� | X | Y |
| A | SO2 | H2S |
| B | Cl2 | CO2 |
| C | NH3 | CO2 |
| D | SO2 | NO2 |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A�� ij��Ӧ�ķ�Ӧ�����������仯��ͼ��ʾ������ͼ������֪�������ı䷴Ӧ���ʱ� | ||||||||||
| B��������Na������O2��Ӧ����Na2O�����¶���������Na2O�������ӿ� | ||||||||||
C����֪��
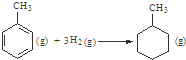 �ġ�HΪ-384 kJ?mol-1 �ġ�HΪ-384 kJ?mol-1 | ||||||||||
| D����������0.10 mol?L-1�İ�ˮ�м�������NH4Cl���壬NH3?H2O�ĵ���̶Ⱥ���Һ��pH����С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��Ϸ��� | �� | �� | �� | ���������� | ���������� |
| A | ���� | ���� | �ռ� | ������ | ������̼ |
| B | �ռ� | ���� | ʳ�� | ����þ | һ����̼ |
| C | ������ | ���� | ̼��� | �������� | �������� |
| D | ���Լ� | ���� | С�մ� | ������ | �������� |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com