
| ||
| 6.4g |
| 64g/mol |
| 0.2mol |
| 4 |
| 0.2mol |
| 2.0L |


科目:高中化学 来源: 题型:
| A、溶于水后得到的溶液能导电的物质 |
| B、NaCl溶液在电流作用下电离成Na+和Cl- |
| C、NaCl是电解质故NaCl晶体能导电 |
| D、氯化氢溶于水能导电,但液态氯化氢不能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑨ | |||
| 4 | ② | ⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O2 |
| O2 |
| H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
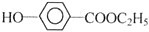
查看答案和解析>>
科目:高中化学 来源: 题型:
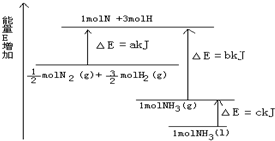 已知化学反应N2+3H2=2NH3的能量变化如图所示,
已知化学反应N2+3H2=2NH3的能量变化如图所示,| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5NA个H2所占的体积约为11.2L |
| B、1 mol OH-所含的电子数为9NA |
| C、标准状况下,9g H2O所占的体积约为11.2L |
| D、标准状况下,28 g CO和N2混合气体的体积约为22.4L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com