
【题目】在工业上,通过含锌矿石制取应用广泛的锌及其化合物。
(1)Zn在元素周期表中位于_____区,其基态原子价电子排布式为________。
(2)[Zn(CN)4]2-常用于电镀工业中,其中配位原子基态时核外电子的轨道表示式为_____,与CN-互为等电子体的粒子有_____、________(写出两种)。
(3)[Zn(CN)4]2-在水溶液中与甲醛(HCHO)溶液反应可制得HOCH2CN。甲醛分子的立体构型为________.中心原子杂化方式为________;HOCH2CN中元素电负性由大到小的顺序_______,1 mol HOCH2CN分子中,含有σ键的数为_________。
(4)ZnS和HgS晶体在岩浆中先晶出的是________,其原因是___________。
(5)ZnO的一种晶体结构与金刚石类似,4 个锌原子占据金刚石中晶胞内四个碳原子的位置,则该氧化物的密度为______g/cm3(设晶胞参数为apm,NA表示阿伏伽德罗常数)
【答案】 ds 3d104s2 ![]() CO N2 平面三角形 sp2 O>N>C>H 6NA ZnS Zn2+半径小于Hg2+半径,ZnS晶格能大于HgS的晶格能
CO N2 平面三角形 sp2 O>N>C>H 6NA ZnS Zn2+半径小于Hg2+半径,ZnS晶格能大于HgS的晶格能 ![]() ×1030
×1030
【解析】(1)Zn为30号元素,价电子排布式为3d104s2,在元素周期表中位于ds区,故答案为:ds;3d104s2;
(2)[Zn(CN)4]2-常用于电镀工业中,其中配位原子为C原子,基态时核外电子的轨道表示式为![]() ,与CN-互为等电子体的粒子有CO和N2,故答案为:
,与CN-互为等电子体的粒子有CO和N2,故答案为:![]() ;CO和N2;
;CO和N2;
(3)甲醛分子中的C原子是sp2杂化,立体构型为平面三角形,根据电负性的变化规律,同一周期从左到右,电负性逐渐增大,同一主族,从上到下,电负性逐渐减小,HOCH2CN中元素电负性由大到小的顺序为O>N>C>H,HOCH2CN的结构简式为HOCH2C≡N,1 mol HOCH2CN分子中,含有σ键6mol,故答案为:平面三角形;sp2 ;O>N>C>H;6NA;
(4)Zn2+半径小于Hg2+半径,ZnS晶格能大于HgS的晶格能,ZnS和HgS晶体在岩浆中先晶出ZnS,故答案为:ZnS;Zn2+半径小于Hg2+半径,ZnS晶格能大于HgS的晶格能;
(5)ZnO的一种晶体结构与金刚石类似,4 个锌原子占据金刚石中晶胞内四个碳原子的位置,根据晶胞结构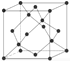 可知,1mol晶胞中含有4molO原子和4molZn原子,1mol晶胞的质量为324g,则该氧化物的密度为
可知,1mol晶胞中含有4molO原子和4molZn原子,1mol晶胞的质量为324g,则该氧化物的密度为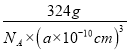 =
=![]() ×1030 g/cm3,故答案为:
×1030 g/cm3,故答案为: ![]() ×1030。
×1030。


科目:高中化学 来源: 题型:
【题目】100ml 1mol/L的AlCl3溶液与100ml 3.5mol/L的NaOH溶液混合,得到沉淀为( )
A. 7.8g B. 0g C. 9.1 g D. 3.9g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加徳罗常数的值。下列说法中不正确的是
A. 0.1mol-NH2(氨基)中所含有的电子数为0.9NA
B. lmol D218O所含的中子数为12NA
C. 14 g聚乙烯与聚丙烯的混合物中含H原子的数目为2NA
D. —定条件下,0.2 mol SO2与足量O2充分反应,生成的SO3分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,向20mL0.1mol/L的HR溶液中滴加0.1mol/LNaOH溶液,溶液的pH与滴加NaOH溶液体积V的关系如图所示。下列说法正确的是

A. HR为强电解质
B. 图中四点,水的电离程度:c>b>d>a
C. 若常温时0.1mol/LHR溶液的电离度为1%,则常温时R-的水解常数约为10-9
D. b点溶液中存在c(Na+)=c(R-)+c(HR)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是 ( )
标准状况下,11.2L的戊烷所含的分子数为0.5NA
B.28g乙烯所含共用电子对数目为4NA
C.标准状况下,11.2 L二氯甲烷所含分子数为0.5 NA
D.现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图的转化关系判断下列说法正确的是(反应条件己略去) ( )

A. 只有反应①②④均属于氧化还原反应
B. 反应⑤说明该条件下铝可用于制熔点较高的金属
C. 相同条件下生成等量的O2,反应③和④转移的电子数之比为1:1
D. 反应①中氧化剂与还原剂的物质的量之比为1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、材料是人类赖以生存和发展的重要物质基础。
(1)钢筋混凝土是重要的建筑材料,钢筋混凝土______ (填“是”或“不是”)复合材料。
(2)有机玻璃受热时会软化,易于加工成型。有机玻璃是一种_________材料(选填“硅酸盐”或“纤维”或“塑料”)。
Ⅱ.(1)我国汉代器物和秦俑彩绘用的颜料“汉紫”,直到近来人们才研究出来,其成分为紫色的硅酸铜钡(铜为+2价),它的化学式为:BaCuSi2Ox,则x的值为 _________
(2)我国新修订的《环境保护法》,使环境保护有了更严格的法律依据。
①北京和张家口市已成功申办2022年冬奥会,目前北京市政府正在全力改善空气质量,下列指标不在空气质量报告范围内的是________ (填字母)。
SO2浓度 b. CO2浓度 c. 可吸入颗粒物
②废旧电池处理不当易造成重金属污染,治理废水中的重金属污染物可用沉淀法。例如,往含铅(Pb2+)废水中加入Na2S使Pb2+转变为__________ (填化学式)沉淀而除去。
③硝酸型酸雨的形成主要是由汽车排放的尾气所致,汽车尾气中的氮氧化物可以用氨气来处理。例如,氨气与二氧化氮在催化剂作用下反应生成的均是对空气无污染的物质,请写出此时氨气与二氧化氮反应的化学方程式: ______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3可用于制造硝酸、纯碱等,还可用于烟气脱硝、脱硫。
(1)利用氧水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下:
SO2(g)+NH3H2O(aq)═NH4HSO3(aq) △H1=akJmol-1
NH3H2O(aq)+NH4HSO3(aq)═(NH4)2SO3(aq)+H2O(l) △H2=bkJmol-1
2(NH4)2SO3(aq)+O2(g)═2(NH4)2SO4(aq) △H3=ckJmol-1
①反应2SO2(g)+4NH3H2O(aq)+O2(g)═2(NH4)2SO4(aq)+2H2O(l)的△H=____kJmol-1。
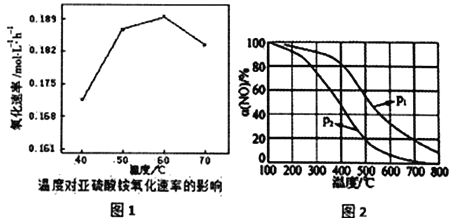
②空气氧化(NH4)2SO3的速率随温度的变化如图所示,则空气氧化(NH4)2SO3的适宜温度为________。
③合成氨用的氢气是以甲烷为原料制得:CH4(g)+H2O(g)CO(g)+3H2(g).而混有的CO对合成氨的催化剂有毒害作用,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中CO,其反应原理为:
[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)![]() [Cu(NH3)3]CH3COOCO(l) △H<0。
[Cu(NH3)3]CH3COOCO(l) △H<0。
吸收CO后的乙酸二氨合铜(I)溶液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是___________________。(填字母)
A.高温、高压B.高温、低压C.低温、低压D.低温、高压
(2)NH3催化氧化可制备硝酸。4NH3(g)+5O2(g)═4NO(g)+6H2O(g)生成的NO被O2氧化为NO2.其他条件不变时,NO的氧化率[α(NO)]与温度、压强的关系如图所示。则p1____p2(填“>”、“<”或“=”);温度高于800℃时,α(NO)几乎为0的原因是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com