
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | A2+与D2-的核外电子数相等 | |
| B. | B与E形成的化合物具有两性 | |
| C. | 氢化物的稳定性为H2E<H2D | |
| D. | C单质与浓度相等的稀盐酸反应比A快 |
分析 元素的最高正价=最外层电子数,最高正价和最低负价绝对值的和为8,D、E两元素最外层电子数为6,故为第ⅥA元素,而D的半径大于E,E为没有最高正价,则E为O元素,D为S元素;B元素最外层电子数为3,为B或Al,但是半径比氧和硫均大,故位于氧元素和硫元素的中间,应为Al;A的半径比铝大,最外层电子数为2,应为Mg,C的半径比Mg小,最外层两个电子,故为Be,然后根据各种元素的原子在周期表中的分布位置确定它们的性质递变规律.
解答 解:元素的最高正价=最外层电子数,最高正价和最低负价绝对值的和为8,D、E两元素最外层电子数为6,故为第ⅥA元素,而D的半径大于E,E为没有最高正价,则E为O元素,D为S元素;B元素最外层电子数为3,为B或Al,但是半径比氧和硫均大,故位于氧元素和硫元素的中间,应为Al;A的半径比铝大,最外层电子数为2,应为Mg,C的半径比Mg小,最外层两个电子,故为Be.
A.A2+是镁离子,D2-是硫离子,它们的核外电子数分别是10和18,核外电子数不相等,故A错误;
B.B与E形成的化合物是氧化铝,属于两性氧化物,既能与强酸反应又能与强碱反应,故B正确;
C.非金属性E>D,所以氢化物稳定性H2O>H2S,即H2E>H2D,故C错误;
D.同主族,从上到下金属性逐渐增强,单质与浓度相等的稀盐酸反应的速率逐渐增大,则速率:A>C,故D错误.
故选B.
点评 本题主要考查了学生有关元素周期表的应用知识,注意根据化合价及原子半径来推断元素是解题的关键,要熟记元素周期表中的递变规律,学以致用,题目难度不大.


科目:高中化学 来源: 题型:解答题
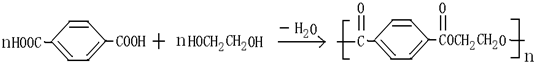
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 601.17KJ | B. | 67.2KJ | C. | 534KJ | D. | 500.4KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40mL 5mol/L的盐酸 | B. | 500mL 1mol/L的氯化钠溶液 | ||
| C. | 100mL 3mol/L的硫酸 | D. | 250mL 2mol/L的氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
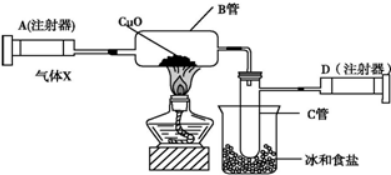
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com