【答案】
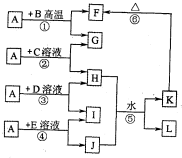
分析:A、G、I均为单质,其中A、G为金属且都常被用作输电线,且G单质有特殊颜色,故G为Cu,A为Al,L是由两种元素组成的盐,它是家庭厨房必备物品,L为NaCl;
B为黑色粉末,由反应①可知,B为CuO,F为A1
2O
3,由反应⑥可知,K为Al(OH)
3;
由反应②可知,C为铜盐,H为铝盐,I为单质,由反应④可知,J中含有Al元素,故反应⑤为铝盐与偏铝酸盐反应生成Al(OH)
3与NaCl,为AlCl
3+NaAlO
2→Al(OH)
3+NaCl,故H为AlCl
3,J为NaAlO
2,C为CuCl
2;
由反应③可知,D为盐酸,I为氢气;由反应④可知,E为NaOH.
解答:解:A、G、I均为单质,其中A、G为金属且都常被用作输电线,且G单质有特殊颜色,故G为Cu,A为Al,L是由两种元素组成的盐,它是家庭厨房必备物品,L为NaCl;
B为黑色粉末,由反应①可知,B为CuO,F为A1
2O
3,由反应⑥可知,K为Al(OH)
3;
由反应②可知,C为铜盐,H为铝盐,I为单质,由反应④可知,J中含有Al元素,故反应⑤为铝盐与偏铝酸盐反应生成Al(OH)
3与NaCl,为AlCl
3+NaAlO
2→Al(OH)
3+NaCl,故H为AlCl
3,J为NaAlO
2,C为CuCl
2;
由反应③可知,D为盐酸,I为氢气;由反应④可知,E为NaOH,则
(1)L为NaCl,由钠离子与氯离子构成,电子式为:
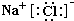
;
故答案为:
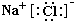
;
(2)F为A1
2O
3,可以用作冶炼铝的原料或用作耐火材料;
故答案为:用作冶炼铝的原料或用作耐火材料;
(3)反应②是Al与氯化铜反应生成氯化铝与铜,反应离子方程式为:2Al+3Cu
2+=2Al
3++3Cu;
故答案为:2Al+3Cu
2+=2Al
3++3Cu;
(4)反应④为2Al+2NaOH+2H
2O=2NaAlO
2+3H
2↑,将该反应设计成原电池,负极发生氧化反应,Al在负极放电,电极反应式为:Al-3e
-+4OH
-=AlO
2-+2H
2O;
故答案为:Al-3e
-+4OH
-=AlO
2-+2H
2O;
(5)能与AlCl
3反应生成Al(OH)
3的物质有:碱或水解呈碱性的物质,AlCl
3溶液与NaHCO
3溶液、NaClO溶液发生双水解反应生成Al(OH)
3,AlCl
3溶液与NH
3?H
2O反应生成Al(OH)
3与氯化铵;
故选cdf;
(6)反应①为2Al+3CuO=Al
2O
3(s)+3Cu,4.0gCuO的物质的量为
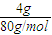
=0.05mol,3molCuO反应放出的热量为20.1kJ×
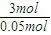
=1206kJ,该反应的热化学方程式为:2Al(s)+3CuO(s)=Al
2O
3(s)+3Cu(s);△H=-1206 kJ/mol;
故答案为:2Al(s)+3CuO(s)=Al
2O
3(s)+3Cu(s);△H=-1206 kJ/mol.
点评:以“无机框图题”的形式考查元素单质及其化合物的性质,涉及常用化学用语等,难度中等,在熟练掌握元素化合物知识的基础上着重考查学生的发散思维、分析判断、逻辑思维以及对无机物知识的综合应用等能力,G的用途与颜色及L的组成与用途是突破口,再利用转化关系进行推理判断.

 ;
;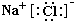 ;
;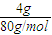 =0.05mol,3molCuO反应放出的热量为20.1kJ×
=0.05mol,3molCuO反应放出的热量为20.1kJ×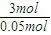 =1206kJ,该反应的热化学方程式为:2Al(s)+3CuO(s)=Al2O3(s)+3Cu(s);△H=-1206 kJ/mol;
=1206kJ,该反应的热化学方程式为:2Al(s)+3CuO(s)=Al2O3(s)+3Cu(s);△H=-1206 kJ/mol;

 百分学生作业本题练王系列答案
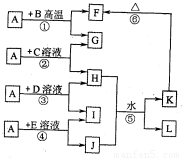
百分学生作业本题练王系列答案 (2012?洛阳二模)如图所示,A、G、I均为单质,其中A、G为金属且都常被用作输电导线材料,B为黑色粉末,L是由两种元素组成的盐,它是家庭厨房必备物品.请回答:
(2012?洛阳二模)如图所示,A、G、I均为单质,其中A、G为金属且都常被用作输电导线材料,B为黑色粉末,L是由两种元素组成的盐,它是家庭厨房必备物品.请回答: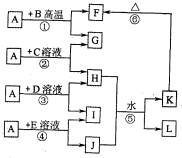 如图所示,A、G、I均为单质,其中A、G为金属且都常被用作输电线,且G单质有特殊颜色,B为黑色粉末,L是由两种元素组成的盐,它是家庭厨房必备物品.请回答:
如图所示,A、G、I均为单质,其中A、G为金属且都常被用作输电线,且G单质有特殊颜色,B为黑色粉末,L是由两种元素组成的盐,它是家庭厨房必备物品.请回答: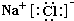
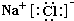
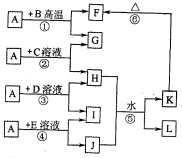 如图所示,A、G、I均为单质,其中A、G为金属且都常被用作输电线,且G单质有特殊颜色,B为黑色粉末,L是由两种元素组成的盐,它是家庭厨房必备物品.请回答:
如图所示,A、G、I均为单质,其中A、G为金属且都常被用作输电线,且G单质有特殊颜色,B为黑色粉末,L是由两种元素组成的盐,它是家庭厨房必备物品.请回答: