
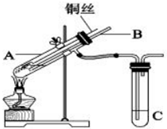
 (1)用铜与浓硫酸反应制取硫酸铜,实验装置如图所示.
(1)用铜与浓硫酸反应制取硫酸铜,实验装置如图所示.分析 (1)①A装置中铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水,浓硫酸表现了酸性和强氧化性;
②装置中导管B的作用使安全装置,起到平衡压强防止倒吸作用,可以通入气体吧生成气体全部赶出到装置C中吸收;
(2)高温灼烧固体应在坩埚中进行,从硫酸铜溶液中得到硫酸铜晶体可以将硫酸铜溶液经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,即可得到产品CuSO4•5H2O晶体,CuSO4•5H2O晶体中的结晶水容易失去,所以干燥需要控制温度小于100℃;
(3)①取a g试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用c mol•L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液6mL.滴定反应如下:Cu2++H2Y2-=CuY2-+2H+铜离子物质的量和标准液物质的量相同=cmol/L×b×10-3L=bc×10-3mol,依据元素守恒得到:
则20ml溶液中含有的CuSO4•5H2O物质的量为6c×10-3mol;100ml溶液中含6c×10-3mol×5=30c×10-3mol,据此计算硫酸铜质量分数;
②滴定实验误差分析依据标准溶液消耗的多少进行分析判断,滴定实验中依据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$分析;
(4)常温下CuSO4溶液中Cu2+水解生成氢氧化铜和氢离子,依据平衡常数概念列式计算,K=$\frac{{c}^{2}({H}^{+})}{c(C{u}^{2+})}$=$\frac{{c}^{2}({H}^{+})}{c(C{u}^{2+})}$×$\frac{{c}^{2}(O{H}^{-})}{{c}^{2}(O{H}^{-})}$=$\frac{K{w}^{2}}{Ksp}$;
解答 解:(1)①A装置中铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水,反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,A中装置体现了浓硫酸的酸性和强氧化性,
故答案为:酸性和强氧化性;
②根据装置图可知,导管B可以平衡试管内外的压强,同时若C的导管堵塞时防止装置爆炸,另外拆除装置前从B管口向A鼓气使二氧化硫被全部吸收,
故答案为:安全管;平衡压强;防止倒吸;若连接C装置导气管堵塞时防止装置爆炸;拆除装置前,从B口向A中鼓气是生成的二氧化硫被完全吸收;
(2)高温灼烧固体应在坩埚中进行,从硫酸铜溶液中得到硫酸铜晶体可以将硫酸铜溶液经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,即可得到产品CuSO4•5H2O晶体,CuSO4•5H2O晶体中的结晶水容易失去,所以干燥需要控制温度小于100℃,
故答案为:坩埚;蒸发浓缩、冷却结晶;CuSO4•5H2O晶体失去部分结晶水;
(3)①取a g试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用c mol•L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液6mL.滴定反应如下:Cu2++H2Y2-=CuY2-+2H+铜离子物质的量和标准液物质的量相同=cmol/L×6×10-3L=6c×10-3mol,依据元素守恒得到:
则20ml溶液中含有的CuSO4•5H2O物质的量为6c×10-3mol;100ml溶液中含6c×10-3mol×5=3c×10-2mol;
所以CuSO4质量分数的表达式=$\frac{3c×1{0}^{-2}mol×160g/mol}{ag}$×100%,
故答案为:$\frac{3c×1{0}^{-2}mol×160g/mol}{ag}$×100%;
②a.用样品溶液润洗锥形瓶,导致待测溶液中溶质增大,导致测定结果偏高,故a错误;
b.滴定终点时俯视滴定管读数说明消耗标准液读数偏小,结果偏低,故b正确;
c.滴定终点时滴定管尖嘴中有气泡,导致标准溶液体积减小,结果偏低,故c正确;
故答案为:bc;
(4)常温下CuSO4溶液中Cu2+水解生成氢氧化铜和氢离子,反应的离子方程式为:Cu2++2H2O?Cu(OH)2+2H+,依据平衡常数概念列式计算,K=$\frac{{c}^{2}({H}^{+})}{c(C{u}^{2+})}$=$\frac{{c}^{2}({H}^{+})}{c(C{u}^{2+})}$×$\frac{{c}^{2}(O{H}^{-})}{{c}^{2}(O{H}^{-})}$=$\frac{K{w}^{2}}{Ksp}$=$\frac{(1{0}^{-14})^{2}}{5.0×1{0}^{-9}}$=2.0×1020,
故答案为:Cu2++2H2O?Cu(OH)2+2H+,2.0×1020;
点评 本题考查物质的分离、实验设计、试剂选择、滴定实验的基本操作和误差分析等知识点,明确离子的性质和滴定实验的定量关系是解本题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①④⑥ | C. | ②③⑤ | D. | ②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 雾霾天气的频繁出现严重影响了我国居民的生活健康.研究显示其中首要污染物为可吸入颗粒物PM2.5,燃煤、机动车和扬尘是造成污染的主要原因.因此,运用化学法防治大气污染是当下重要的研究方向.
雾霾天气的频繁出现严重影响了我国居民的生活健康.研究显示其中首要污染物为可吸入颗粒物PM2.5,燃煤、机动车和扬尘是造成污染的主要原因.因此,运用化学法防治大气污染是当下重要的研究方向.| 离子 | Na+ | K+ | NH4+ | NO3- | SO42- | Cl- |
| 浓度/mol•L-1 | 7×10-6 | 3×10-6 | 2×10-5 | 5×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,n(CO2):n(NH3)=1:1 | |
| B. | 达到化学平衡时,n(CO2):n(H20)=1:1 | |
| C. | 达到化学平衡时,n[CO(NH2)2]:n(H20)=1:1 | |
| D. | 达到化学平衡时,n(NH3):n(H20)=1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si投入NaOH溶液中 Si+2OH-═SiO32-+H2 | |
| B. | 把 Al中投入到少量氢氧化钠溶液 Al3++3OH-═Al(OH)3↓ | |
| C. | 向明矾溶液中加入氢氧化钡溶液,恰好使“SO42-”完全沉淀 Al3++2SO42-+2Ba2++3OH-═2BaSO4↓+Al(OH)3↓ | |
| D. | Na[Al(OH)4]溶液中加入过量CO2[Al(OH)4]-+CO2═HCO3-+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃与60℃时,水的pH相等 | |
| B. | FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3 | |
| C. | 常温,在0.10mol/L的NH3•H2O溶液中加入少量NH4Cl晶体,能使NH3•H2O的电离度降低,溶液pH值减小 | |
| D. | 向沸水中加入适量饱和的FeCl3溶液,可形成带电的胶体,其导电能力增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(CH3COO-) | |
| B. | 在0.1 mol•L-1 NaHS溶液中:c(H+)=c(S2-)+c(OH-)+c(HS-) | |
| C. | 将0.1 mol•L-1 Na2CO3溶液和0.2 mol•L-1 NaHCO3溶液等体积混合:3c(Na+)=4c(CO32-)+4c(HCO3-) | |
| D. | 向0.1 mol•L-1 NaHSO4溶液中滴加氨水至溶液恰好呈中性:c(Na+)=c(NH4+)=c(SO42-)>c(OH-)=c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com