
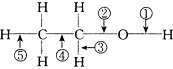
 .
. 分析 乙醇含有羟基,可发生取代、氧化和消去反应,结合官能团的变化解答(1)~(4);
(5)2-丙醇催化氧化生成丙酮;
(6)甲醇为共价化合物,含有甲基和羟基.
解答 解:(1)乙醇发生消去反应生成乙烯和水,②⑤键断裂,故答案为:②⑤;
(2)乙醇与金属反应生成氢气,①键断裂,故答案为:①;
(3)乙醇在银催化下与O2反应生成乙醛和水,①③键断裂,故答案为:①③;
(4)乙醇与HX反应生成卤代烃和水,②键断裂,故答案为:②;
(5)2-丙醇被氧化生成丙酮化学方程式为:2CH3CH(OH)CH3+O2 $→_{△}^{Cu}$2CH3COCH3+H2O;
故答案为:2CH3CH(OH)CH3+O2 2CH3COCH3+H2O;
(6)甲醇为共价化合物,其结构式为 ,每一个短线代表一对电子,则其电子式为
,每一个短线代表一对电子,则其电子式为
故答案为: .
.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意常见有机物的性质,题目难度不大.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:填空题
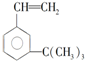 有如下性质:
有如下性质: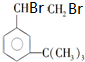 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 已知:1molC、1molCO分别按下式反应(燃烧):
已知:1molC、1molCO分别按下式反应(燃烧):查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某科研机构用NaOH溶液吸收硫酸工业废气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到某种副产物,其原理如图所示(电极材料为石墨).
某科研机构用NaOH溶液吸收硫酸工业废气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到某种副产物,其原理如图所示(电极材料为石墨).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{15}^{52}$P的原子核中含有15个中子 | |
| B. | ${\;}_{15}^{52}$P的相对原子质量为32 | |
| C. | ${\;}_{15}^{52}$P原子的质量数是17 | |
| D. | ${\;}_{15}^{52}$P原子中含有的电子数和质子数都是15 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com