
 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:分析 (1)依据配制一定物质的量浓度溶液的一般步骤选择需要的仪器;确定用不到的和缺少的仪器;依据配制溶液的体积选择需要容量瓶规格;
(2)容量瓶为精密仪器不能稀释浓溶液、不能用于溶解固体、储存溶液等;
(3)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(4)依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度;溶液稀释过程溶液所含溶质的物质的量保持不变,据此计算需要浓硫酸体积和使用量筒规格;
(5)错误的操作发生后,能补救的就补救,不能补救的则重新配制;
解答 解:(1)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,用到的仪器:托盘天平、药匙、烧杯、玻璃棒、容量瓶、胶头滴管,用不到的仪器:平底烧瓶和分液漏斗;仪器C的名称为分液漏斗;需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL,实验室没有450mL容量瓶,所以应选择500mL容量瓶;
故答案为:AC;分液漏斗;500mL容量瓶;
(2)容量瓶只能用来配制一定体积准确浓度的溶液,不能配制或测量容量瓶规格以下的任意体积的液体,不能稀释或溶解药品,不能用来加热溶解固体溶质,
故选:BCD;
(3)若定容时仰视刻度线,导致溶液体积偏大,溶液浓度偏小;
若NaOH溶液未冷却即转移至容量瓶定容,冷却后,溶液体积偏小,溶液浓度偏大;
故答案为:小于;大于;
(4)质量分数为98%、密度为1.84g/cm3的浓硫酸物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设0.5mol/L硫酸溶液500mL需要浓硫酸体积为V,则依据溶液稀释过程溶液所含溶质的物质的量保持不变得:V×18.4mol/L=0.5mol/L×500mL,解得V=13.6mL,用选择25mL量筒;
故答案为;13.6;25.0;
(5)如果定容时不小心超过刻度线,实验失败,且不能补救,必须重新配制;
故答案为:重新配制.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理和操作步骤是解题关键,注意容量瓶、量筒规格的选择,题目难度不大.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:解答题
 取6根铁钉,6支干净的试管及其他材料,如图所示.
取6根铁钉,6支干净的试管及其他材料,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | B. | c(H+)=c(OH-)+c(NH3•H2O) | ||
| C. | c(SO42-)+c(OH-)=c(NH4+)+c(Fe2+)+c(H+) | D. | c(NH3•H2O)+c(NH4+)=0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
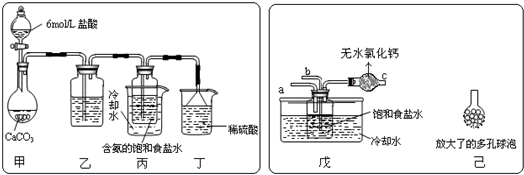
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
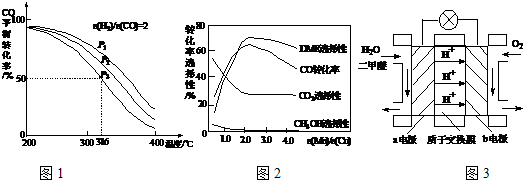
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
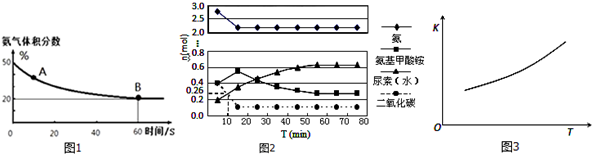
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
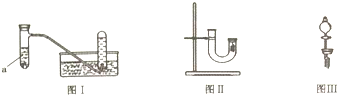
| 实验步骤 | 问题 |
| 1.从U型管左端加入稀硝酸直至充满U型管右端 | / |
| 2.用附有铜丝的胶塞塞住U型管右端,观察现象 | U型管右端产生无色气体,溶液变蓝色 |
| 3.待反应停止后打开胶塞,观察实验现象 | 现象是无色气体与空气接触后立即变成红棕色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式: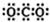 | |
| B. | CS2分子的结构式:S═C═S | |
| C. | S2-的结构示意图: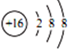 | |
| D. | 8个中子的碳原子的核素符号:${\;}_{8}^{14}$C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com