
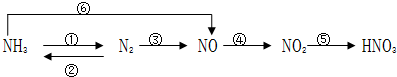
·ÖĪö £Ø1£©¶žŃõ»ÆĢ¼”¢¶žŃõ»ÆĮņŗĶ¼īČÜŅŗ·“Ӧɜ³ÉŃĪŗĶĖ®£¬·¢ÉśµÄŹĒø“·Ö½ā·“Ó¦ŹōÓŚĖįŠŌŃõ»ÆĪļ£¬¶žŃõ»ÆĮņÖŠĮņŌŖĖŲ»ÆŗĻ¼Ū+4¼Ū“¦ÓŚÖŠ¼ä¼ŪĢ¬£¬¼Č¾ßÓŠŃõ»ÆŠŌŅ²¾ßÓŠ»¹ŌŠŌ£¬¶žŃõ»ÆĮņ“ß»ÆŃõ»ÆÉś³ÉČżŃõ»ÆĮņ£»
£Ø2£©ĀČĘųŗĶĖ®·“Ӧɜ³É“ĪĀČĖįŗĶŃĪĖį£¬ĘäÖŠÓėĢ¼ĖįÄĘ·“Ó¦µÄŹĒŃĪĖį£¬ÓėĻõĖįŅųČÜŅŗ·“Ó¦µÄŹĒŃĪĖį£¬Ę·ŗģČÜŅŗĶŹÉ«µÄŹĒ“ĪĀČĖįµÄĘư׊Ō£¬ĀČ»ÆŃĒĢśČÜŅŗ¾ßÓŠ»¹ŌŠŌ£¬æÉŅŌ±»ĀČĘųŃõ»ÆĪŖĀČ»ÆĢś£»
£Ø3£©ŅĄ¾ŻµŖŌŖĖŲŹŲŗć¼ĘĖć£®
½ā“š ½ā£ŗ£Ø1£©¶žŃõ»ÆĢ¼”¢¶žŃõ»ÆĮņŗĶ¼īČÜŅŗ·“Ӧɜ³ÉŃĪŗĶĖ®£¬·¢ÉśµÄŹĒø“·Ö½ā·“Ó¦ŹōÓŚĖįŠŌŃõ»ÆĪļ£¬¶žŃõ»ÆĮņŗĶĒāŃõ»ÆÄĘČÜŅŗ·“Ӧɜ³ÉŃĒĮņĖįÄĘŗĶĖ®£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗSO2+2OH-=SO32-+H2O£¬¶žŃõ»ÆĮņÖŠĮņŌŖĖŲ»ÆŗĻ¼Ū+4¼Ū“¦ÓŚÖŠ¼ä¼ŪĢ¬£¬¼Č¾ßÓŠŃõ»ÆŠŌŅ²¾ßÓŠ»¹ŌŠŌ£¬¶žŃõ»ÆĮņ“ß»ÆŃõ»ÆÉś³ÉČżŃõ»ÆĮņ£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ2SO2+O2$\frac{\underline{“߻ƼĮ}}{”÷}$2SO3£¬
¹Ź“š°øĪŖ£ŗĖį£¬SO2+2OH-=SO32-+H2O£»Ńõ»Æ”¢»¹Ō£¬2SO2+O2$\frac{\underline{“߻ƼĮ}}{”÷}$2SO3£»
£Ø2£©ĀČĘųŗĶĖ®·“Ӧɜ³É“ĪĀČĖįŗĶŃĪĖį£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗCl2+H2O=HCl+HClO£¬ĘäÖŠÓėĢ¼ĖįÄĘ·“Ó¦µÄŹĒŃĪĖį£¬2H++CO32-=CO2”ü+H2O£¬ÓėĻõĖįŅųČÜŅŗ·“Ó¦µÄŹĒŃĪĖį£¬Ag++Cl-=AgCl”ż£¬Ę·ŗģČÜŅŗĶŹÉ«µÄŹĒ“ĪĀČĖįµÄĘư׊Ō£¬ĀČ»ÆŃĒĢśČÜŅŗ¾ßÓŠ»¹ŌŠŌ£¬æÉŅŌ±»ĀČĘųŃõ»ÆĪŖĀČ»ÆĢś£¬2FeCl2+Cl2=2FeCl3£¬
¹Ź“š°øĪŖ£ŗCl2+H2O=HCl+HClO£¬H+£¬Cl-£¬HClO£¬Cl2 £»
£Ø3£©ČōÖʱø¹ż³ĢÖŠNŌŖĖŲµÄĄūÓĆĀŹĪŖ80%£¬Ōņ17KgNH3×ī¶ąæÉÖʵĆĻõĖįæÉŅŌĄūÓƵ«ŌŖĖŲŹŲŗć¼ĘĖć£¬ÉčÉś³ÉĻõĖįÖŹĮæĪŖx
NH3”«HNO3
17 63
17kg”Į80% x
x=50.4kg
¹Ź“š°øĪŖ£ŗ50.4£®
µćĘĄ ±¾Ģāæ¼²éĮĖŌŖĖŲ»ÆŗĻĪļŠŌÖŹ£¬Ö÷ŅŖŹĒĀČĘų”¢¶žŃõ»ÆĮņ¼°Ęä»ÆŗĻĪļŠŌÖŹµÄÓ¦ÓĆ£¬×÷ĪŖ»ł“”ŹĒ½āĢā¹Ų¼ü£¬ĢāÄæ½Ļ¼ņµ„£®


 ŠĀĖ¼Ī¬¼ŁĘŚ×÷ŅµŹī¼Ł¼ŖĮÖ“óѧ³ö°ęÉēĻµĮŠ“š°ø
ŠĀĖ¼Ī¬¼ŁĘŚ×÷ŅµŹī¼Ł¼ŖĮÖ“óѧ³ö°ęÉēĻµĮŠ“š°ø Ą¶Ģģ½ĢÓżŹī¼ŁÓÅ»ÆѧĻ°ĻµĮŠ“š°ø
Ą¶Ģģ½ĢÓżŹī¼ŁÓÅ»ÆѧĻ°ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ²»æÉÄÜŹĒÓŠ»śĪļ | B£® | Ņ»¶ØŹĒ¼«ŠŌ·Ö×Ó | C£® | æÉÄÜŹĒĄė×Ó¾§Ģå | D£® | Ņ»¶ØŹĒ·Ö×Ó¾§Ģå |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĪļÖŹµÄĮæ£ŗøö | B£® | Ħ¶ūÖŹĮæ£ŗmol/g | ||
| C£® | °¢·üŁ¤µĀĀŽ³£Źż£ŗmol | D£® | ĪļÖŹµÄĮæÅØ¶Č£ŗmol/L |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | NaŗĶAl | B£® | NaŗĶMg | C£® | MgŗĶAl | D£® | NaŗĶFe |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
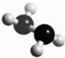 ėĀ£ØN2H4£©ŹĒ»š¼żČ¼ĮĻ£¬³£ĪĀĻĀĪŖŅŗĢ壬Ęä·Ö×ÓµÄĒņ¹÷Ä£ŠĶČēĶ¼ĖłŹ¾£®ėĀÄÜÓėĖ«ŃõĖ®·¢Éś·“Ó¦£ŗN2H4+2H2O2ØTN2+4H2O£®ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
ėĀ£ØN2H4£©ŹĒ»š¼żČ¼ĮĻ£¬³£ĪĀĻĀĪŖŅŗĢ壬Ęä·Ö×ÓµÄĒņ¹÷Ä£ŠĶČēĶ¼ĖłŹ¾£®ėĀÄÜÓėĖ«ŃõĖ®·¢Éś·“Ó¦£ŗN2H4+2H2O2ØTN2+4H2O£®ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©| A£® | 11.2L N2ÖŠŗ¬µē×Ó×ÜŹżĪŖ7”Į6.02”Į1023 | |
| B£® | 3.2g N2H4ÖŠŗ¬ÓŠ¹²¼Ū¼üµÄ×ÜŹżĪŖ6”Į6.02”Į1022 | |
| C£® | ±ź×¼×“æöĻĀ£¬22.4L H2O2ÖŠĖłŗ¬Ō×Ó×ÜŹżĪŖ4”Į6.02”Į1023 | |
| D£® | ČōÉś³É3.6g H2O£¬ŌņÉĻŹö·“Ó¦×ŖŅʵē×ӵďżÄæĪŖ2”Į6.02”Į1022 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ijĪļÖŹ¼ČÄÜČÜÓŚŃĪĖį£¬ÓÖÄÜČÜÓŚNaOHČÜŅŗ£¬ŌņøĆĪļÖŹŅ»¶ØŹĒAl2O3 | |
| B£® | ijĘųĢåÖ»ŗ¬C”¢HĮ½ÖÖŌŖĖŲ£¬ĒŅÖŹĮæÖ®±ČĪŖ6£ŗ1£¬ŌņøĆĘųĢåŅ»¶ØĪŖ“æ¾»Īļ | |
| C£® | SO2ĶØČėĘ·ŗģČÜŅŗÖŠ£¬ČÜŅŗĶŹÉ«£¬ŌņSO2ĶØČė×ĻÉ«ŹÆČļŹŌŅŗÖŠ£¬ČÜŅŗŅ²ĶŹÉ« | |
| D£® | ÅØĻõĖįŌŚ¹āÕÕĢõ¼žĻĀ±ä»Ę£¬ĖµĆ÷ÅØĻõĖį²»ĪČ¶Ø£¬Éś³ÉµÄÓŠÉ«²śĪļÄÜČÜÓŚÅØĻõĖį |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | H2£Øg£©+Cl2£Øg£©ØT2HCl£Øg£©”÷H=-184.8KJ/mol | |
| B£® | C2H4£Øg£©+O2£Øg£©ØT2CO2£Øg£©+2H2O£Øl£©”÷H=-1411.0KJ/mol | |
| C£® | CH4£Øg£©+$\frac{3}{2}$O2£Øg£©ØTCO£Øg£©+2H2O£Øl£©”÷H=-6071.3KJ/mol | |
| D£® | H2£Øg£©+$\frac{1}{2}$O2£Øg£©ØTH2O£Øg£©”÷H=-241.8KJ/mol |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017Ń§ÄźÉ½¶«Ź”øßŅ»ÉĻ10ŌĀŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠŹōÓŚµē½āÖŹ²¢Äܵ¼µēµÄĪļÖŹŹĒ
A£®ČŪČŚµÄNaCl B£®KNO3ČÜŅŗ C£®µ„ÖŹĶ D£®¾Ę¾«
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com