
(12分)在一定条件下,存在如下反应:2SO2(g)+ O2 (g)  2SO3(g);ΔH<0
2SO3(g);ΔH<0
(1)写出该反应的化学平衡常数表达式K=
(2)升高温度,该反应K值 ,SO2转化率 ,正反
应速率 (填增大、减小或不变)
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是 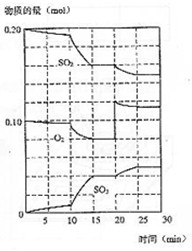
(4)据图判断,反应进行至20min时,曲线发生变化的原因
是___________________(用文字表达),10min到15min的曲线变化的原因可能是 (填编号)。
| A.加了催化剂 | B.缩小容器体积 |
| C.降低温度 | D.增加SO3物质的量 |
科目:高中化学 来源:黑龙江哈九中2011-2012学年度高二上学期期中考试化学试题(人教版) 题型:022
在一定条件下,存在如下反应:2SO2(g)+O2(g)![]() 2SO3(g);ΔH<0
2SO3(g);ΔH<0
(1)写出该反应的化学平衡常数表达式K=________
(2)升高温度,该反应K值________,SO2转化率________,正反应速率________(填增大、减小或不变)
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是________
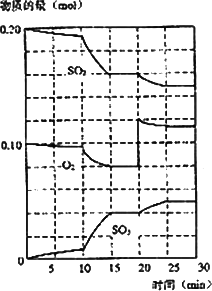
(4)据图判断,反应进行至20 min时,曲线发生变化的原因是________(用文字表达),10 min到15 min的曲线变化的原因可能是________(填编号).
A.加了催化剂
B.缩小容器体积
C.降低温度
D.增加SO3物质的量
(5)在25℃下,将amol/L的氨水与0.01 mol/L的盐酸等体积混合,反应平衡时溶液中c(NH![]() )=c(Cl-),则溶液显________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=________.
)=c(Cl-),则溶液显________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=________.
查看答案和解析>>
科目:高中化学 来源:2004全国各省市高考模拟试题汇编·化学 题型:043
已知
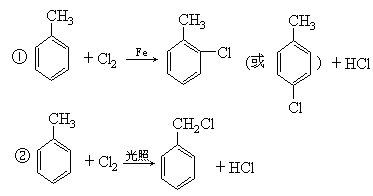
某有机物A的相对分子质量为198.5,A在铁粉存在下跟氯气反应时,当A分子中只有1个氢原子被氯原子取代时能得到两种有机产物;而在光照下A跟氯气反应时,当A分子中的1个氢原子被氯原子取代时,只能得到一种有机产物;A跟碳酸氢钠反应,能产生使澄清石灰水变浑浊的无色气体;A在NaOH存在下水解后的溶液用稀硝酸酸化,再加入硝酸银溶液,会立即生成白色沉淀.
A在一定条件下可发生如图的反应,最终生成D和F,即
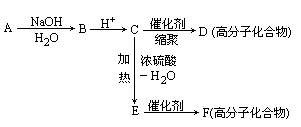
请回答:
(1)写出下列物质的结构简式:
A________,D________.
(2)写出C→E的化学方程式:
________.
(3)指出下列反应的反应类型:
A→B________,E→F________.
查看答案和解析>>
科目:高中化学 来源:江苏省盐城上冈高级中学2007高三第二次阶段考试、化学试题 题型:022
| |||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下可实现如图所示物质之间的变化,其中甲、乙为金属单质,丙、丁、戊为非金属单质,B为氧化物。
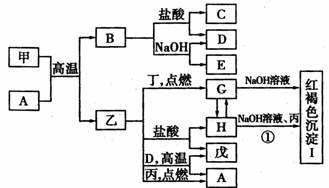
请填写下列空白:
(1)物质A的化学式是____________,乙在元素周期表中的位置是____________。
(2)甲与NaOH溶液反应的离子方程式是___________ ___________。
描述反应①发生的现象是_____________________。
(3)乙在丙、D同时存在的条件下,可发生电化学腐蚀,写出正极上的电极反应式
_________________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com