
【题目】(5分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。
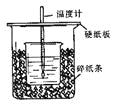
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),
【答案】1)环形玻璃搅拌器(2)减少实验过程中热量损失(3)偏小(4)不相等;相等;因为中和热是指在稀溶液中,酸跟碱发生中和反应生成1molH2O所放出的能量,与酸碱用量无关
【解析】
(1)根据所以装置图结合实验原理判断仪器;
(2)根据中和热测定实验过程中要尽可能减少热量损失分析;
(3)根据中和热测定实验过程中要尽可能减少热量损失分析;
(4)根据反应物的用量判断放出的热量,根据中和热概念分析。
(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒。
(2)实验过程中尽可能减少热量的损失,因此烧杯间填满碎纸条的作用是保温,减少实验过程中的热量损失。
(3)大烧杯上如不盖硬纸板,导致热量散失,求得的中和热数值偏小。
(4)如果实验中改用60 mL0.50 mol·L-1的盐酸跟50mL 0.55 mol·L-1的NaOH溶液进行反应,与上述实验相比,生成水的物质的量增加,所放出的热量不相等;中和热是强酸、强碱生成1mol水所对应的反应热,因此所求中和热相等。


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
【题目】现有下列4种物质:①浓H2SO4、②NO2、③NH4Cl、④NaHCO3。其中,可以使蔗糖变黑的是______(填序号);与水发生反应由红棕变为无色的是______(填序号);加热分解,遇冷又化合的是______(填序号);加热分解生产无色无味气体的反应方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是主要大气污染物之一,工业上可用如下装置吸收转化SO2(A、B为惰性电极)。下列说法正确的是
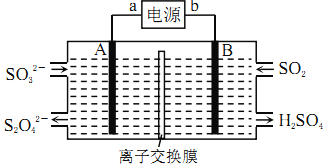
A. 电子流动方向为:B→b→a→A
B. a、A极上均发生氧化反应
C. 离子交换膜为阳离子交换膜
D. B极上的电极反应式为:SO2+2eˉ+2H2O=SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求对下图中两极进行必要的连接并填空: 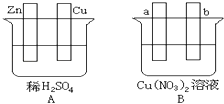
(1)在A图中,使铜片上冒H2气泡.请加以必要连接,则连接后的装置叫 . 电极反应式:锌板:;铜板: .
(2)在B图中,使a极析出铜,则b析出: . 加以必要的连接后,该装置叫 . 电极反应式,a极: b极: . 在经过一段时间后,停止反应并搅均溶液,溶液的pH(升高、降低、不变),加入一定量的后,溶液能恢复至与电解前完全一致.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、废水废气对自然环境有严重的破坏作用,大气和水污染治理刻不容缓。
(1)某化工厂产生的废水中含有Fe2+、Mn2+等金属离子,可用过硫酸铵[(NH4)2S2O8]氧化除去。
①过硫酸铵与Mn2+反应生成MnO2的离子方程式为__________。
②温度与Fe2+、Mn2+氧化程度之间的关系如图所示:
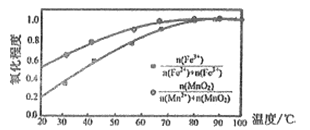
实验过程中应将温度控制在_________。
Fe2+与Mn2+被氧化后形成胶体絮状粒子,常加入活性炭处理,加入活性炭的目的为_______。
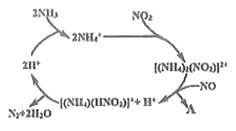
(2)利用某分子筛作催化剂,NH3可脱除废气中NO、NO2,其反应机理如图所示。A包含物质的化学式为N2和__________。
(3)工业上废气中SO2可用Na2CO3溶液吸收,反应过程中溶液组成变化如图所示。
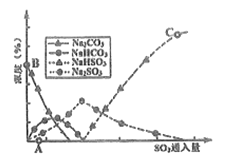
①吸收初期(图中A点以前)反应的化学方程式为__________。
②C点高于B点的原因是__________。
Ⅱ、研究发现,NOx和SO2是雾霾的主要成分。
已知:N2(g)+O2(g)=2NO(g) ΔH=+1805kJ/mol①
C(s)+O2(g)=CO2(g) ΔH=-393.5kJ/mol②
2C(s)+O2(g)=2CO(g) ΔH-221.0kJ/mol③
(4)某反应的平衡常数表达式![]() ,请写出此反应的热化学方程式:__________。
,请写出此反应的热化学方程式:__________。
(5)向绝热恒容密闭容器中充入等量的NO和CO进行反应,能判断反应已达到化学平衡状态的是_______(填序号)。
a.容器中的压强不变 b.2v正(CO)=v逆(N2)
c.气体的平均相对分子质量保持34.2不变 d.该分应平衡常数保持不变
e.NO和CO的体积比保持不变
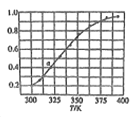
(6)2SO(g)![]() 2SO2(g)+O2(g),将一定量的SO3放入恒容密闭容器中,测得其平衡转化率随温度变化如图所示。图中a点对应温度下,已知SO3的起始压强为P0,该温度下反应的平衡常数Kp=____(用平衡分压代昝平衡浓度计算,分压=总压×物质的量分数)。
2SO2(g)+O2(g),将一定量的SO3放入恒容密闭容器中,测得其平衡转化率随温度变化如图所示。图中a点对应温度下,已知SO3的起始压强为P0,该温度下反应的平衡常数Kp=____(用平衡分压代昝平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学平衡常数可以用 K 来表示,下列关于 K 的说法中正确的是( )
A. K 越大,反应物的转化率越小 B. K 与温度一定有关
C. K 与生成物的浓度一定有关 D. K 与反应物的浓度一定有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,以硼氢化合物NaBH4(B元素的化合价为+3)和H2O2作原料的燃料电池可用作空军通信卫星电源,负极材料采用Pt/C,正极材料采用MnO2 , 其工作原理如图所示.下列说法正确的是( ) 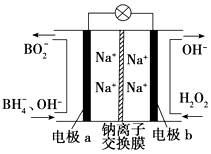
A.每消耗1 mol H2O2 , 转移的电子为1 mol
B.电极b采用MnO2 , MnO2既作电极材料又有催化作用
C.该电池的正极反应为BH4﹣+8OH﹣﹣8e﹣═BO2﹣+6H2O
D.电池放电时Na+从b极区移向a极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一小块钠投入到滴有酚酞溶液的水中,下列有关该实验现象的描述错误的是( )
A.钠在水面游动B.钠熔成闪亮的小球
C.钠沉在水底D.溶液变为红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有室温下四种溶液,有关叙述不正确的是( )
① | ② | ③ | ④ | |
浓度c/mol/L | 0.1 | 0.1 | 0.1 | 0.1 |
溶液 | 氨水 | CH3COONa溶液 | 醋酸 | 盐酸 |
A.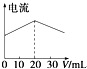 在20 mL ①溶液中逐滴加入③溶液,溶液导电能力变化如图
在20 mL ①溶液中逐滴加入③溶液,溶液导电能力变化如图
B.②、③两溶液等体积混合,离子浓度:2c(Na+)=c(CH3COO﹣)+c(CH3COOH)
C.①、④两溶液等体积混合,离子浓度:c(Cl﹣)>c(NH4+)>c(H+)>c(OH﹣)
D.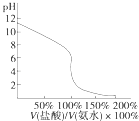 用④滴定①,滴定曲线如图,可用酚酞作指示剂
用④滴定①,滴定曲线如图,可用酚酞作指示剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com