

分析 (1)完全燃烧,生成CO2和H2O.浓硫酸增重18克为生成水的质量,碱石灰增重35.2克为生成二氧化碳的质量,根据n=$\frac{m}{M}$计算生成的水、二氧化碳的物质的量,根据质量守恒确定有机物中C、H、O原子个数比值,确定最简式,根据最简式确定分子式,根据分子式确定相对分子质量;
(2)根据有机物原子个数比值可确定最简式,结合氢的饱和度可确定有机物分子式;
(3)A的红外光谱图上有C-H键、O-H键、C-O键的振动吸收峰,A的核磁共振氢谱有两个峰说明只有两种氢原子,结合A的分子式确定A的结结构简式.
解答 解:(1)完全燃烧,生成CO2和H2O.浓硫酸增重18克为生成水的质量,其物质的量=$\frac{18g}{18g/mol}$=1mol,n(H)=2mol,碱石灰增重35.2克为生成二氧化碳的质量,其物质的量=$\frac{35.2g}{44g/mol}$=0.8mol,n(C)=0.8mol,根据质量守恒n(O)=$\frac{14.8g-0.8mol×12g/mol-2mol×1g/mol}{16g/mol}$=0.2mol,有机物A中C、H、O原子个数之比为0.8mol:2mol:0.2mol=4:10:1,最简式为C4H10O,氢已经达到饱和,所以分子式为C4H10O,其相对分子质量为74,
故答案为:74;
(2)有机物A中C、H、O原子个数之比为0.8mol:2mol:0.2mol=4:10:1,最简式为C4H10O,氢的最大饱和度为2n+2,n为碳数,氢已经达到饱和,所以分子式为C4H10O,其相对分子质量为74,
故答案为:C4H10O;
(3)A的红外光谱图上有C-H键、O-H键、C-O键的振动吸收峰,说明存在C-H键、O-H键、C-O键,A的核磁共振氢谱有两个峰说明只有两种氢原子,所以A的结构简式为:(CH3)3COH,
故答案为:(CH3)3COH.
点评 本题考查有机物分子式与结构确定,题目难度不大,根据有机物的性质与结构特点确定A的结构简式是解题的关键,侧重对基础知识与学生综合能力考查.


科目:高中化学 来源: 题型:解答题
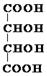 .
.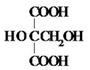 .M的核磁共振氢谱图中有4组吸收峰.
.M的核磁共振氢谱图中有4组吸收峰.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大量塑料废弃物会造成严重的白色污染,应将其焚烧处理 | |
| B. | 应用放射性同位素发射出的射线,可进行食物保鲜和肿瘤治疗 | |
| C. | 过度开采使用煤、石油等化石燃料,会导致空气中PM2.5浓度升高 | |
| D. | 近两年全国普遍取消了各种节日焰火晚会,对减缓空气污染起到了一定作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l) | B. | HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l) | ||
| C. | 2H2(g)+O2(g)═2H2O(l) | D. | 2FeCl3(aq)+Fe(s)═3FeCl3(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
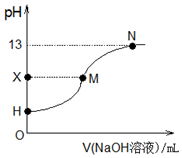
| A. | 酸碱滴定选用指示剂:甲基橙试液 | |
| B. | H点处的溶液:pH<3 | |
| C. | X=7时,M点对应加入氢氧化钠溶液的体积:25.00 mL | |
| D. | H、M、N三点各自对应的溶液:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
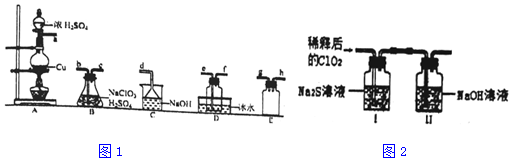
| 操作步骤 | 实验现象 | 结论 |
| 取少量I中溶液于试管甲中,滴加品红溶液和盐酸 | 品红始终不褪色 | ①无_SO2(或HSO3-或SO32-)生成 |
| 另取少量I中溶液于试管乙中,加入Ba(OH)2溶液,振荡 | ②白色沉淀 | 有SO42- |
| ③继续在试管乙中滴加Ba(OH)2溶液至过量,静置,取上层清液于试管丙中,________ | 有白色沉淀生成 | 有Cl-生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用加酶洗衣粉洗衣服时水的温度越高越好 | |
| B. | “光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化物有关 | |
| C. | 小苏打是制作馒头的膨松剂,苏打是治疗胃酸过多的抗酸剂 | |
| D. | 乙醇、过氧化氢、次氯酸钠等消毒液的消毒原理都是利用其强氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com