
下列叙述正确的是( )
|
| A. | 0.1 mol•L﹣1CH3COOH溶液加水稀释,溶液中所有离子浓度均减小 |
|
| B. | 常温下,在由水电离出的c(OH﹣)=1×10﹣12mol•L﹣1的溶液中,Al3+可能大量存在 |
|
| C. | 常温下,向AgCl悬浊液中加入少量NaCl固体后振荡,Ksp(AgCl)增大 |
|
| D. | 常温下,相同浓度的CH3COONa溶液与Na2CO3溶液相比,Na2CO3溶液的pH小 |
考点:
弱电解质在水溶液中的电离平衡;盐类水解的应用;难溶电解质的溶解平衡及沉淀转化的本质.
专题:
电离平衡与溶液的pH专题;盐类的水解专题.
分析:
A.稀释醋酸溶液,醋酸中氢氧根离子浓度增大;
B.酸或碱抑制水电离,根据水的电离确定溶液酸碱性,再结合离子共存判断;
C.温度不变,溶度积常数不变;
D.相同温度、相同浓度下,酸根离子水解程度越大,其钠盐溶液pH越大.
解答:
解:A.稀释醋酸溶液,促进醋酸电离,溶液中氢离子浓度减小,温度不变,水的离子积常数不变,则醋酸中氢氧根离子浓度增大,故A错误;
B.酸或碱抑制水电离,常温下,由水电离出的c(OH﹣)=1×10﹣12mol•L﹣1<10﹣7mol•L﹣1,则溶液为酸性或碱性,酸性条件下Al3+能大量存在,故B正确;
C.温度不变,溶度积常数不变,与物质浓度无关,故C错误;
D.相同温度、相同浓度下,酸根离子水解程度越大,其钠盐溶液pH越大,碳酸根离子水解程度大于醋酸根离子,所以Na2CO3溶液的pH大,故D错误;
故选B.
点评:
本题考查了弱电解质的电离、盐类水解、溶度积常数等知识点,明确弱电解质的电离特点、盐类水解特点等知识点来分析解答,注意:平衡常数只与温度有关,为易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
完成下列反应的离子方程式:
①碳酸钙溶于醋酸中 ;
②向稀氨水中加入稀盐酸 ;
③向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式: ;在以上中性溶液中继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
如图为元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法错误的是( )
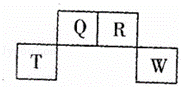
|
| A. | 气态氢化物稳定性:R>Q |
|
| B. | 元素T的离子结构示意图为 |
|
| C. | 与w同主族的某元素形成的18电子的氢化物分子中只有共价键没有离子键 |
|
| D. | Q可形成多种含氧酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
KMnO4溶液常用作氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作是:(1)称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸1h;(2)用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;(3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处;(4)利用氧化还原滴定方法,在700C-800C条件下用基准试剂(纯度高、相对分子质量较大、稳定性较好的物质)溶液标定其浓度。请回答下列问题:
(1)将溶液加热并保持微沸1h的目的是 。
(2)如何保证在700C~800C条件下进行滴定操作: 。
(3)准确量取一定体积的KMnO4溶液用________________(填仪器名称)。
(4)在下列物质中,用于标定KMnO4溶液的基准试剂最好选用_________(填序号)。
A.H2C2O4·2H2O B.FeSO4 C.浓盐酸 D.Na2SO3
(5)若准确称取Wg你选的基准试剂溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液VmL。问:
①滴定终点标志是________________;
②所配制KMnO4标准溶液的物质的量浓度为__________mol/ L;
(6)若用放置两周的KMnO4标准溶液去滴定水样中Fe2+含量,测得的浓度值将________(填“偏高”或“偏低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应属于取代反应的是( )
|
| A. | C2H4+3O2 | B. | Zn+CuSO4═ZnSO4+Cu |
|
| C. | NaCl+AgNO3═AgCl↓+NaNO3 | D. | CH2Cl2+Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)实验室在临时配制一些氯化铁溶液时,常将氯化铁固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,是为了 .氯化铁水溶液呈 性,原因是(用离子方程式表示): .
(2)物质的量浓度均为0.1mol/L的下列溶液pH 由大到小的顺序 (用序号表示)
①CH3COOH ②NH4Cl ③NaHCO3 ④Ba(OH)2 ⑤NaOH ⑥Na2CO3
(3)物质的量浓度相同的下列溶液按c(CO32﹣)由大到小的顺序是
①Na2CO3 ②NaHCO3 ③H2CO3 ④(NH4)2CO3.
查看答案和解析>>
科目:高中化学 来源: 题型:
反应4A(g)+5B(g)═4C(g)+6D(g),在5L的密闭容器中进行,半分钟后,C的物质的量增加了0.30mol.下列叙述正确的是( )
|
| A. | A的平均反应速率是0.010 mol•L﹣1•s﹣1 |
|
| B. | 容器中含D物质的量至少为0.45 mol |
|
| C. | 容器中A、B、C、D的物质的量的比一定是4: 5:4:6 |
|
| D. | 容器中A的物质的量一定增加了0.30 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学反应的方程式书写正确的是( )
A. 高温下加热硝酸铵固体:NH4NO3 NH3↑+HNO3↑
NH3↑+HNO3↑
B. 将铝片加入烧碱溶液中:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑
C. 向亚硫酸钠溶液中加入足量硝酸:SO32﹣+2H+=SO2↑+H2O
D. 工业制粗硅:C+SiO2 CO2↑+Si
CO2↑+Si
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com