
【题目】目前我国研制的稀土催化剂催化转化汽车尾气示意图如图:
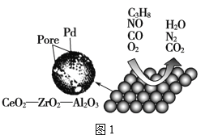
(1)Zr原子序数为40,价电子排布式为___。图1中属于非极性的气体分子是___。
(2)①氟化硼(BF3)是石油化工的重要催化剂。BF3中B-F比BF![]() 中B—F的键长短,原因是___。
中B—F的键长短,原因是___。
②乙硼烷(B2H6)是用作火箭和导弹的高能燃料,氨硼烷(H3NBH3)是最具潜力的储氢材料之一。
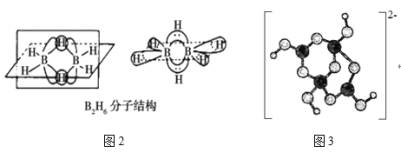
B2H6的分子结构如图2所示,其中B原子的杂化方式为___。
③H3NBH3的相对分子质量与B2H6相差不大,但是H3NBH3的沸点却比B2H6高得多,原因是__。
④硼酸盐是重要的防火材料。图3是硼酸钠晶体中阴离子(含B、O、H三种元素)的结构,该晶体中含有的化学键有__。
A.离子键 B.极性键 C.非极性键 D.配位键 E.金属键
(3)CO与Ni可生成羰基镍[Ni(CO)4],已知其中镍的化合价为0,[Ni(CO)4]的配体中配位原子是___。
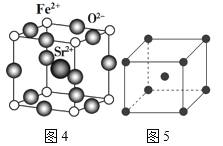
(4)为了节省贵金属并降低成本,也常用钙钛矿型复合氧化物作为催化剂。一种复合氧化物结构如图4所示,则与每个Sr2+紧邻的O2-有___个。
(5)与Zr相邻的41号元素Nb金属的晶格类型为体心立方晶格(如图5所示),原子半径为apm,相对原子质量为b,阿伏加德罗常数为NA,试计算晶体铌的密度为___g·cm-3(用来a、b、NA表示计算结果)。
【答案】4d25s2 O2、N2、CO2 BF3中B采用sp2杂化,BF4-中B采用sp3杂化,s轨道成分越多,电子云重叠程度越大,键长越短。(或BF3中除了σ键,还有(Π46)大π键) sp3 H3NBH3分子间存在氢键,分子间作用力更大 ABD C 12 ![]()
【解析】
(1)Zr原子序数为40,原子核外有40个电子,根据核外电子排布规律可得其基态原子的核外电子排布为[Kr]4d25s2,价电子排布为4d25s2;O2、N2均为双原子分子构成的气体,属于非极性分子,CO2分子为直线形,正负电荷中心重合,属于非极性分子;
(2)①BF3中B原子价层电子对数为3,采用sp2杂化,BF![]() 中B原子中心价层电子对数为4,采用sp3杂化,s轨道成分越多,电子云重叠程度越大,键长越短(或BF3中除了σ键,还有(Π46)大π键);
中B原子中心价层电子对数为4,采用sp3杂化,s轨道成分越多,电子云重叠程度越大,键长越短(或BF3中除了σ键,还有(Π46)大π键);
②据图可知B2H6分子中每个B原子和4个氢原子形成4个σ键,价层电子对数为4,所以为sp3杂化;
③N的电负性较大,所以H3NBH3分子间存在氢键,分子间作用力更大,沸点更高;
④硼酸钠晶体中有硼酸根和钠离子之间的离子键,阴离子中O原子和B原子、O原子和H原子之间存在极性键;B的最外层电子数为3,据图可知部分B原子形成4个共价键,所以其中有配位键,综上所述存在离子键、极性键、配位键,所以选ABD;
(3)[Ni(CO)4]的配体为CO,C原子和O原子均含有孤电子对,但C的电负性较小,更容易给出电子,所以配位原子为C;
(4)Sr2+在晶胞的体心,与之紧邻的O2-在晶胞的棱上,所以每个Sr2+紧邻的O2-有12;
(5)体心立方堆积模型中,位于体对角线上的3个原子相切,设晶胞的棱长为r,则有![]() =4a,解得r=
=4a,解得r=![]() a pm,则晶胞的体积V=
a pm,则晶胞的体积V=![]() pm3;根据均摊法晶胞中Nb原子的个数为
pm3;根据均摊法晶胞中Nb原子的个数为![]() =2,所以晶胞的质量为
=2,所以晶胞的质量为![]() g,所以晶胞密度为
g,所以晶胞密度为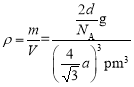 =
=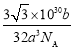 g/cm3。
g/cm3。


科目:高中化学 来源: 题型:
【题目】次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O,M=154.0g·mol-1)俗称吊白块,易溶于水,微溶于乙醇,在120℃以上易分解。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
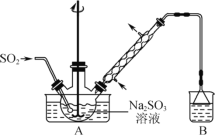
步骤1:在三颈烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH 约为4,制得NaHSO3溶液。
步骤2:向三颈烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80℃~90℃下,反应约3h,冷却至室温,抽滤。
步骤3:将滤液经结晶、抽滤、洗涤等操作后制得粗产品。
(1)步骤2中加入锌粉反应时会有Zn(OH)2生成,写出发生反应的化学方程式_____________;为防止生成的Zn(OH)2覆盖在锌粉表面阻止反应进行,可采取的措施是_____________。
(2)下列说法中不正确的是_____________。
A.装置B的作用是吸收尾气
B.该实验的加热方式最好选用水浴加热
C.步骤2抽滤的滤渣成分只有Zn(OH)2固体
D.步骤3得到的产品可以在烘箱中高温烘干
(3)如图装置,经过一系列操作完成步骤3中的结晶和洗涤操作。请选择合适的字母,按正确的操作顺序补充完整(洗涤操作只需考虑一次):_____→固液转移至布氏漏斗→开抽气泵→c→f→________→_________→_________→________→d→关抽气泵。_____________
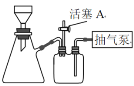
a.将滤液蒸发至大量晶体出现
b.将滤液真空浓缩,冷却结晶
c.关闭活塞A
d.打开活塞A
e.加乙醇洗涤
f.确认抽干
(4)将0.5000g样品充分加热分解,释放出的HCHO用36.00mL0.1000mol·L-1KMnO4溶液吸收(不考虑SO2的影响,5HCHO+4![]() +12H+=5CO2↑+4Mn2++11H2O),再用0.1000mol·L-1H2C2O4溶液滴定KMnO4溶液,重复实验3次,平均消耗H2C2O4溶液的体积为30.00mL,则样品的纯度为_____________。
+12H+=5CO2↑+4Mn2++11H2O),再用0.1000mol·L-1H2C2O4溶液滴定KMnO4溶液,重复实验3次,平均消耗H2C2O4溶液的体积为30.00mL,则样品的纯度为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的一种同位素X的原子质量数为A,含N个中子,它与![]() 原子组成HmX分子.在a克HmX中所含质子的物质的量是( )
原子组成HmX分子.在a克HmX中所含质子的物质的量是( )
A. ![]() (A-N+m)molB.
(A-N+m)molB. ![]() (A-N)molC.
(A-N)molC. ![]() (A-N)molD.
(A-N)molD. ![]() (A-N+m)mol
(A-N+m)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是由常见元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(部分物质已经略去)。其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。

(1)写出C→E的化学方程式: 。
(2)实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为: ,干燥C常用 (填写试剂名称)。
(3)E物质遇到D物质时,会观察到 现象,若用排水法收集F,则最终集气瓶中收集到的气体为 (填写物质的化学式)。
(4)写出A→D的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10mL0.1mol·L-1一元弱碱XOH溶液中逐滴滴加0.1mol·L-1的HCl溶液,溶液的AG![]() 变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是
变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是

A. 若a=-8,则Kb(XOH)≈10-5
B. M点表示盐酸和XOH恰好完全反应
C. R点溶液中可能存在c(X+)+c(XOH)=c(Cl-)
D. M点到N点,水的电离程度先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息填空。
(1)A的名称是________.
(2)③的反应类型是________,④的反应类型是________.
(3)反应②的化学方程式是________
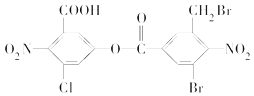
(4)某有机物的结构简式如图所示.1mol该有机物与足量的NaOH溶液共热,充分反应后质的量为________ mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】看图回答下列问题
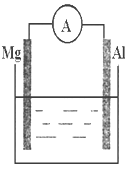
(1)若烧杯中溶液为稀硫酸,则观察到的现象是__________,电流表指针_______(填偏转或不偏转),两极反应式为:
正极_______________________;
负极________________________。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为__________(填Mg或Al),总反应方程式为__________。
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如右下图所示:A、B两个电极均由多孔的碳块组成。
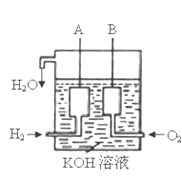
该电池的正极反应式为:_____________________。
(4)如果将上述装置中通入的H2改成CH4气体,也可以组成一个原电 池装置,电池的总反应方程式为:CH4+2O2+2KOH=K2CO3+3H2O,则该电池的负极反应式为:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验现象和解释或结论都正确的是( )
选项 | 实验操作 | 现象 | 解释或结论 |
A | 取硫酸催化淀粉水解的反应液,滴入少量新制 | 有砖红色沉淀生成 | 葡萄糖具有还原性 |
B |
| 有白色絮状沉淀生成 | 二者水解相互促进生成氢氧化铝沉淀 |
C | 将充满 | 红棕色变深 | 反应 |
D | 向 | 得到红褐色透明液体 | 得到 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物J是一种常用的抗组胺药物,一种合成路线如下:
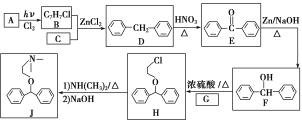
已知:①C为最简单的芳香烃,且A、C互为同系物。
②2ROH+NH3![]() HNR2+2H2O(R代表烃基)。
HNR2+2H2O(R代表烃基)。
请回答下列问题:
(1)A的化学名称是___________,H中的官能团名称是_________________。
(2)由D生成E的反应类型是________,G的结构简式为_______________。
(3)B+C―→D的化学方程式为_____________________________________。
(4)L是F的同分异构体,含有联苯(![]() )结构,遇FeCl3溶液显紫色,则L有_______种(不考虑立体异构)。其中核磁共振氢谱为六组峰,峰面积之比为3∶2∶2∶2∶2∶1的结构简式为___________________。
)结构,遇FeCl3溶液显紫色,则L有_______种(不考虑立体异构)。其中核磁共振氢谱为六组峰,峰面积之比为3∶2∶2∶2∶2∶1的结构简式为___________________。
(5)写出用氯乙烷和2氯1丙醇为原料制备化合物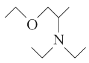 的合成路线(其他无机试剂任选)。________________
的合成路线(其他无机试剂任选)。________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com