
��10�֣���1����֪ij��Ӧ��ƽ�ⳣ������ʽΪ��K= ����������Ӧ��Ӧ�Ļ�ѧ����ʽ�� ��
����������Ӧ��Ӧ�Ļ�ѧ����ʽ�� ��
��2���ϳɼ״�����Ҫ��Ӧ�ǣ�2H2(g)+CO(g)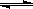 CH3OH(g) ��H=-90.8 kJ��mol-1��t���´˷�Ӧ��ƽ�ⳣ��Ϊ160�����¶��£����ܱ������п�ʼֻ����CO��H2����Ӧl0min���ø���ֵ�Ũ�����£�
CH3OH(g) ��H=-90.8 kJ��mol-1��t���´˷�Ӧ��ƽ�ⳣ��Ϊ160�����¶��£����ܱ������п�ʼֻ����CO��H2����Ӧl0min���ø���ֵ�Ũ�����£�
���� | H2 | CO | CH3OH |
Ũ�ȣ�mol/L�� | 0.2 | 0.1 | 0.4 |
��A����ʱ����ڷ�Ӧ����v(H2)=
��B���Ƚϴ�ʱ�����淴Ӧ���ʵĴ�С��v�� v�棨�>������<����=����
��C����Ӧ�ﵽƽ����������������䣬��ֻ�������������Сһ�룬ƽ����
(�������������)�ƶ���ƽ�ⳣ��K (���������С�� ���䡱)��
��1��C+H2O (g) 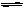 CO + H2 ��2����A��0.08 mol/(L?min) ��B���� ��C������ ����
CO + H2 ��2����A��0.08 mol/(L?min) ��B���� ��C������ ����
��������
�����������1��ƽ�����ʽΪ��K=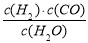 ��������ΪCO��H2����Ӧ�ﺬ��H2O������ѧ�������ֱ�Ϊ1��1��1������ԭ���غ㣬����һ��Ӧ��Ϊ����C����Ӧ��ѧ����ʽΪC��s��+H2O��g��?CO��g��+H2��g������2����A���ɱ������ݿ�֪��l0min�ڼ״���Ũ�ȱ仯Ϊ0.4mol/L����v��CH3OH��=
��������ΪCO��H2����Ӧ�ﺬ��H2O������ѧ�������ֱ�Ϊ1��1��1������ԭ���غ㣬����һ��Ӧ��Ϊ����C����Ӧ��ѧ����ʽΪC��s��+H2O��g��?CO��g��+H2��g������2����A���ɱ������ݿ�֪��l0min�ڼ״���Ũ�ȱ仯Ϊ0.4mol/L����v��CH3OH��=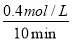 =0.04mol/��L?min��������֮�ȵ��ڻ�ѧ������֮�ȣ���v��H2��=2v��CH3OH��=2��0.04mol/��L?min��=0.08mol/��L?min������B��10minʱ��CO��Ũ��Ϊ0.1mol/L��������Ũ��Ϊ0.2mol/L���״���Ũ��Ϊ0.4mol/L���ʴ�ʱ��Ũ����Qc=
=0.04mol/��L?min��������֮�ȵ��ڻ�ѧ������֮�ȣ���v��H2��=2v��CH3OH��=2��0.04mol/��L?min��=0.08mol/��L?min������B��10minʱ��CO��Ũ��Ϊ0.1mol/L��������Ũ��Ϊ0.2mol/L���״���Ũ��Ϊ0.4mol/L���ʴ�ʱ��Ũ����Qc=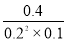 =100��С��ƽ�ⳣ��160���ʷ�Ӧ������Ӧ���У���v����v�棻��C�������������Сһ�룬ѹǿ����ƽ���������С�ķ����ƶ�����ƽ��������Ӧ�ƶ���ƽ�ⳣ��ֻ���¶�Ӱ�죬��ѹǿ�أ��¶Ȳ��䣬ƽ�ⳣ�����䡣
=100��С��ƽ�ⳣ��160���ʷ�Ӧ������Ӧ���У���v����v�棻��C�������������Сһ�룬ѹǿ����ƽ���������С�ķ����ƶ�����ƽ��������Ӧ�ƶ���ƽ�ⳣ��ֻ���¶�Ӱ�죬��ѹǿ�أ��¶Ȳ��䣬ƽ�ⳣ�����䡣
���㣺���黯ѧƽ�ⳣ�������塣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ����11���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���з�Ӧ�����ӷ���ʽ����ȷ����
A��̼�������Һ�������������������Һ��Ca2++HCO3-+OH-��CaCO3��+H2O
B�������ʵ�����NH4HCO3��NaOH����Һ�з�Ӧ��NH4����OH����NH3��H2O
C���ں���Mn2+����Һ�м���HNO3�ữ���ټ���PbO2����Ӧ��ϵ���Ϻ�ɫ��5PbO2 + 2Mn2+ + 4H+ = 5Pb2+ + 2MnO4�� + 2H2O
D�������ͬŨ��NaHSO4��Ba��OH��2����Һ��ϣ�H++SO42��+Ba2++OH����BaSO4��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ��һ��ѧ�����л�ѧ�Ծ��������棩 ���ͣ������
��.�����¼������ʣ���ʳ�ξ��� ���Ҵ� ��ˮ�� ������ �ݱ����ᣨ�����ᾧ�壩
��KNO3��Һ �����ڵ��������� ��Һ̬�Ȼ��� ��ջش�����ţ���
��1�������й��ɵ���ֻ���ڹ̶�λ�������� ����2���������ʿ��Ե����� ��
��3���������������ڵ���ʵ��� �� ��4���������������ڷǵ������ ��
��.��1��O2��SO2��SO3��������֮��Ϊ1��2��5�������ǵ���ԭ����֮��Ϊ ��
��2��ij�����Ȼ���MCl2 40.5 g�к���0.6 mol Cl������MCl2��Ħ������Ϊ ������M�����ԭ������Ϊ ����3����V LFe2(SO4)3��Һ�к���m g Fe3+����C Fe3+Ϊ_______________������ȡ��V/4L��Һ����SO42-���ʵ���Ũ��Ϊ_______________���ٽ���V/4L��Һ��Һϡ�͵�4L��ϡ�ͺ���Һ�����ʵ����ʵ���Ũ��Ϊ___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ��һ��ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʵ�������ȷ����
A������ʱΪ�ӿ��ٶȣ����Ƚ��ϲ���Һע��������У��ٽ�����ת�Ƶ���������
B������ʱ�ò��������裬��Ϊ��ʹ�����Ĺ��������ܽ�
C������ʱ����������Ͽڽ�ˮ���¿ڳ�ˮ
D����Һʱ���²�Һ�������ٴ��¿ڷų��ϲ�Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ��һ��ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
����������֯��WHO����ClO2��ΪA1����Ч��ȫ���������������ʳƷ���ʡ�����ˮ���������й㷺��Ӧ�á�ClO2����
A.�� B.�� C.�Ȼ��� D.������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
����������Ӧ���Ȼ�ѧ����ʽΪ��
��I2(g)+H2(g)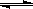 2HI(g) ��H= - 9.48 kJ��mol-1
2HI(g) ��H= - 9.48 kJ��mol-1
��I2(s)+H2(g)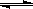 2HI(g) ��H= + 26.48 kJ��mol-1���ɴ��ж�����˵����Ӧ��ȷ����
2HI(g) ��H= + 26.48 kJ��mol-1���ɴ��ж�����˵����Ӧ��ȷ����
A����Ӧ�ٵIJ���ȷ�Ӧ�ڵIJ����ȶ�
B��I2(s)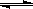 I2(g) ��H= + 17.00 kJ��mol-1
I2(g) ��H= + 17.00 kJ��mol-1
C����Ӧ�ڵķ�Ӧ���������ȷ�Ӧ�ٵķ�Ӧ����������
D��1 mol I2(g)��ͨ��1 mol H2(g)����Ӧ�����9.48 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��˹����ָ������ѧ��Ӧ�ķ�Ӧ��ֻ�뷴Ӧ��ʼ̬������Ӧ�����̬����������йأ�������巴Ӧ���е�;���ء�����A��һ�������¿ɷ���һϵ��ת��������ͼ�ж����й�ϵ�������
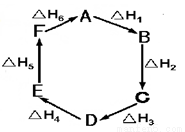
A��A��F����H = - ��H 6
B����H1+��H 2+��H 3+��H 4+��H 5+��H 6=1
C��C��F��|��H| = |��H 1+��H 2+��H 6 |
D����H 1+��H 2+��H 3 = -��H 4-��H5-��H 6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������б�������У��һ11��������ѧ�Ծ��������棩 ���ͣ�ѡ����
��a g�����Ͻ��ĩ�������������У��������NaOH��Һ�����˳���������ϴ�ӡ�������գ��õ�����ɫ��ĩ��������Ϊa g����ԭ�Ͻ���������������Ϊ
A��70% B��52.4% C��47.6% D��30%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������б�������У�߶�11��������ѧ�Ծ��������棩 ���ͣ�ѡ����
���й���ƽ�ⳣ��K��˵���У���ȷ����
A�����κ������£���ѧƽ�ⳣ����һ���㶨ֵ
B���ı䷴Ӧ��Ũ�Ȼ�������Ũ�ȶ���ı�ƽ�ⳣ��K
C��ƽ�ⳣ��Kֻ���¶��йأ��뷴ӦŨ�ȡ�ѹǿ��
D����ƽ�ⳣ��K�Ĵ�С�����ƶ�һ����Ӧ���еij̶�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com