
| ||
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
- 4 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 化学键 | 键能(kJmol) | 化学键 | 键能(kJmol) |
| NN | 942 | H-O | 460 |
| N-N | 391 | 0=0 | 499 |
| H-H | 437 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与pH=2的CH3COOH溶液中c(H+)相同 |
| B、与等体积pH=12的氨水混合后所得溶液pH=7 |
| C、与等体积pH=12的氢氧化钡溶液混合后所得溶液pH=7 |
| D、与等体积0.01mol?L-1 CH3COONa溶液混合后所得溶液中c(Cl-)=c(CH3C00-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙酸的结构简式:C2H4O2 |
| B、中子数为20的氯原子:2017Cl |
C、S2-的结构示意图: |
D、NH3 的电子式: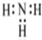 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用蒸馏原理从海水中提取淡水是海水淡化技术发展的新方向 |
| B、因海水中含有镁元素,故不需经过化学变化就可以得到镁单质 |
| C、从海水中可得到NaCl,电解熔融NaCl或NaCl的水溶液都可制得Cl2 |
| D、无论是海水波浪发电还是潮汐发电,都是将化学能转化为电能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com