
分析 首先通过0.448L CO2,物质的量为:$\frac{0.448L}{22.4L/mol}$=0.02mol,可以知道碳酸镁有0.02mol,5.82g沉淀中有0.02mol 氢氧化镁,即1.16g,所以硫酸钡4.66g,物质的量为:0.02mol,而pH=12,所以氢氧根离子0.01mol/L,氢氧根离子为:0.01mol/L×0.2L=0.002mol,原有0.05mol氢氧根,减去氢氧化镁的0.04mol 氢氧根离子,再减去溶液中还剩下的0.002mol 氢氧根,剩下的0.008mol的氢氧根就是和多余的氢离子反应的,和碳酸镁反应的氢离子有0.04mol,因此总的氢离子0.048mol,结果是1.2mol/L,由此分析解答.
解答 解:首先通过0.448L CO2,物质的量为:$\frac{0.448L}{22.4L/mol}$=0.02mol,可以知道碳酸镁有0.02mol,5.82g沉淀中有0.02mol 氢氧化镁,即1.16g,所以硫酸钡4.66g,物质的量为:0.02mol,而pH=12,所以氢氧根离子0.01mol/L,氢氧根离子为:0.01mol/L×0.2L=0.002mol,原有0.05mol氢氧根,减去氢氧化镁的0.04mol 氢氧根离子,再减去溶液中还剩下的0.002mol 氢氧根,剩下的0.008mol的氢氧根就是和多余的氢离子反应的,和碳酸镁反应的氢离子有0.04mol,因此总的氢离子0.048mol,结果是1.2mol/L,
(1)原混合物中MgCO3的物质的量为:0.02mol,答:原混合物中MgCO3的物质的量为0.02mol;
(2)得到的沉淀中BaSO4的质量5.82g-1.16g=4.66g,答:得到的沉淀中BaSO4的质量为:4.66g;
(3)因此总的氢离子0.048mol,所以盐酸的物质的量为:0.048mol,盐酸的物质的量浓度为:$\frac{0.048mol}{0.04L}$=1.2mol/L,答:盐酸的物质的量浓度为:1.2mol/L.
点评 本题考查混合物的有关计算,难度中等,清楚固体质量是什么成份是解题的关键,注意差量法的利用,学生要注意公式有应用.


科目:高中化学 来源: 题型:选择题
| A. | 导电塑料是应用于电子工业的一种新型有机高分子材料 | |
| B. | 复合材料一般是以一种材料作基体,另一种材料作为增强体 | |
| C. | 高分子分离膜应用于食品工业中,可用子浓缩天然果汁、乳制品加工、酿造业等 | |
| D. | 合成高分子材料制成的人工器官都会受到人体的排斥作用,难以达到生物相容的程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
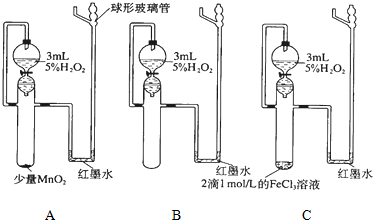
| 实验目的 | 催化剂对过氧化氢分解化学反应速率影响 | ||
| 实验步骤 | 在三个相同的带活塞的漏斗中分别加入2~3mL约5%的H2O2,然后在一支试管中滴加2滴1mol/L的FeCl3溶液,另一支试管中加入少量MnO2固体.同时向三支试管中放入漏斗中的全部溶液,观察红墨水上升情况. | ||
| 反应条件 | A少量MnO2 | B无催化剂 | C 2滴FeCl3溶液 |
| 实验现象 | |||
| 反应速 率大小 | (用v (A)、v (B)、v (C)表示) | ||
| 得出结论 | |||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
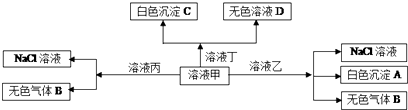
| A. | 甲为AlCl3,乙为NaHCO3 | |
| B. | 在甲中滴加丁开始反应的离子方程式:2HCO3-+Ba2++2OH-B═aCO3↓+2H2O+CO32- | |
| C. | 白色沉淀A不能溶解在溶液丁中 | |
| D. | 在丙中可以大量共存的有:Fe2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
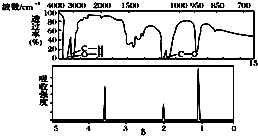
| A. | 由核磁共振氢谱可知,该有机物中至少有三种不同的化学键 | |
| B. | 由红外光谱可知,该有机物分子中有三种不同的氢原子 | |
| C. | 若A的化学式为C2H6O,则其结构简式为CH3-O-CH3 | |
| D. | 仅由其核磁共振氢谱无法得知其分子中的氢原子总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (A-x+n) mol | B. | (A-x-n) mol | C. | (A-x+n)$\frac{w}{A}$ mol | D. | (A-x-n)$\frac{w}{A}$ mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com